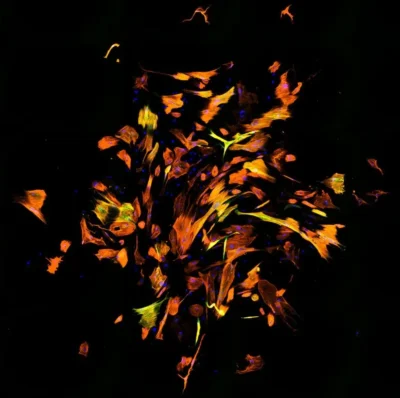
(Ascl1-Immagine: fibroblasti umani riprogrammati in cellule simili a cardiomiociti. L’immunofluorescenza mostra diverse molecole: DNA (blu), Troponina T cardiaca (arancione) e αActinina (verde). Credito: Qian Lab, UNC School of Medicine).
Secondo una nuova ricerca, una proteina che aiuta nello sviluppo dei neuroni, funziona anche per riprogrammare le cellule del tessuto cicatriziale nelle cellule del muscolo cardiaco.
I ricercatori della University of North Carolin School of Medicine hanno fatto importanti passi avanti negli entusiasmanti campi della riprogrammazione cellulare e della rigenerazione degli organi e le loro scoperte potrebbero avere un impatto importante sullo sviluppo di futuri trattamenti per i cuori danneggiati.
Gli scienziati dell’Università della Carolina del Nord a Chapel Hill hanno trovato un modo più snello ed efficace per riprogrammare i fibroblasti, che sono le cellule che compongono il tessuto cicatriziale, in modo che diventino cellule muscolari cardiache sane (cardiomiociti) in uno studio che è stato recentemente pubblicato sulla rivista Cell Stem Cell. I fibroblasti sono responsabili del tessuto fibroso e rigido che porta all’insufficienza cardiaca dopo un infarto a causa di malattie cardiache. La trasformazione dei fibroblasti in cardiomiociti è allo studio come possibile trattamento futuro o addirittura cura per questa condizione diffusa e mortale.
Sorprendentemente, la chiave del nuovo approccio alla produzione di cardiomiociti si è rivelata essere Ascl1, una proteina di controllo dell’attività genica nota per essere importante nella conversione dei fibroblasti in neuroni. In precedenza si presumeva che Ascl1 fosse specifica dei neuroni.
“È una scoperta fuori dagli schemi e ci aspettiamo che sia utile nello sviluppo di future terapie cardiache e potenzialmente altri tipi di riprogrammazione cellulare terapeutica”, ha affermato l’autore senior dello studio Li Qian, Ph.D., Professore associato presso il Dipartimento dell’UNC di Patologia e Medicina di laboratorio e Direttore associato del McAllister Heart Institute presso la UNC School of Medicine.
Gli scienziati negli ultimi 15 anni hanno sviluppato varie tecniche per riprogrammare le cellule adulte in modo che diventino cellule staminali, quindi, indurre quelle cellule staminali a diventare cellule adulte di qualche altro tipo. Più recentemente, gli scienziati hanno trovato il modo di eseguire questa riprogrammazione in modo più diretto, direttamente da un tipo di cellula matura a un altro. La speranza è che quando questi metodi saranno resi estremamente sicuri, efficaci ed efficienti, i medici saranno in grado di utilizzare una semplice iniezione nei pazienti per riprogrammare le cellule dannose in cellule benefiche.
“La riprogrammazione dei fibroblasti è stato a lungo uno degli obiettivi importanti nel campo”, ha affermato Qian. “L’eccessiva attività dei fibroblasti è alla base di molte malattie e condizioni importanti, tra cui insufficienza cardiaca, broncopneumopatia cronica ostruttiva, malattie del fegato, malattie renali e il danno cerebrale simile a una cicatrice che si verifica dopo l’ictus”.
Nel nuovo studio, il team di Qian, inclusi i primi coautori Haofei Wang, Ph.D., ricercatore post-dottorato e Benjamin Keepers, ha utilizzato tre tecniche esistenti per riprogrammare i fibroblasti di topo in cardiomiociti, cellule epatiche e neuroni. Il loro scopo era catalogare e confrontare i cambiamenti nei modelli di attività genica delle cellule e nei fattori di regolazione dell’attività genica durante queste tre distinte riprogrammazioni.
Vedi anche:L’ormone dell’amore potrebbe guarire il tuo cuore
Inaspettatamente, i ricercatori hanno scoperto che la riprogrammazione dei fibroblasti in neuroni ha attivato una serie di geni dei cardiomiociti. Ben presto hanno stabilito che questa attivazione era dovuta ad Ascl1, una delle proteine del “fattore di trascrizione” del programmatore principale che era stata utilizzata per creare i neuroni.
Poiché Ascl1 ha attivato i geni dei cardiomiociti, i ricercatori lo hanno aggiunto al cocktail di tre fattori di trascrizione che avevano utilizzato per produrre i cardiomiociti, per vedere cosa sarebbe successo. Sono rimasti sbalorditi nello scoprire che ha aumentato notevolmente l’efficienza della riprogrammazione – la proporzione di cellule riprogrammate con successo – di oltre dieci volte. In effetti, i ricercatori hanno scoperto che ora potevano fare a meno di due dei tre fattori del loro cocktail originale, conservando solo Ascl1 e un altro fattore di trascrizione chiamato Mef2c.
In ulteriori esperimenti, hanno trovato prove che Ascl1 da sola attiva sia i geni dei neuroni che dei cardiomiociti, ma si allontana dal ruolo pro-neurone quando è accompagnato da Mef2c. In sinergia con Mef2c, Ascl1 attiva un’ampia serie di geni dei cardiomiociti.
“Ascl1 e Mef2c lavorano insieme per esercitare effetti pro-cardiomiociti che nessuno dei due fattori esercita da solo, creando un potente cocktail di riprogrammazione”, ha detto Qian.
I risultati mostrano che i principali fattori di trascrizione utilizzati nella riprogrammazione cellulare diretta non sono necessariamente esclusivi di un tipo cellulare mirato.
Forse ancora più importante, rappresentano un altro passo verso le future terapie di riprogrammazione cellulare per i principali disturbi. Qian dice che lei e il suo team sperano di creare una proteina sintetica due in uno che contenga i frammenti efficaci sia di Ascl1 che di Mef2c e che potrebbe essere iniettata nei cuori deboli per ripararli.
Fonte: Cell Stem Cell