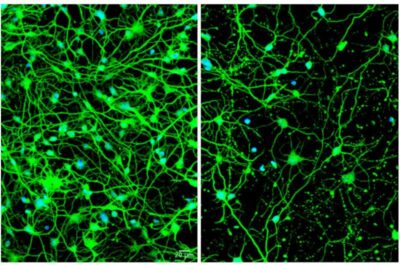
(Malattia di Huntington -Immagine: sinistra sono mostrati i neuroni derivsati dalle cellule della pelle di un giovane paziente con malattia di Huntington presintomatica. Sulla destra ci sono i neuroni derivati dalle cellule della pelle di un paziente anziano con Huntington sintomatica; queste cellule sono sparse perché il processo di invecchiamento compromette l’autofagia, portando alla morte cellulare. Credito: Youngmi Oh, Seongwon Lee).
La malattia di Huntington, una condizione neurodegenerativa ereditaria fatale, è causata da un errore genetico presente alla nascita, sebbene i suoi sintomi spesso non inizino fino alla metà dell’età adulta.
Gli scienziati della Washington University School of Medicine di St. Louis hanno cercato di capire come il processo di invecchiamento innesca l’insorgenza dei sintomi, con l’aspettativa che tale conoscenza possa indicare trattamenti che ritardano o prevengono la neurodegenerazione.
A tal fine, un nuovo studio della Washington University indica che con l’invecchiamento dei pazienti, la malattia compromette gradualmente un importante processo di pulizia cellulare chiamato autofagia, che è responsabile dell’eliminazione dei rifiuti dalle cellule. Questa pulizia è significativa nell’Huntington perché un accumulo di rifiuti in un tipo specifico di neurone porta alla morte prematura di tali cellule.
I ricercatori hanno anche dimostrato che il miglioramento del percorso dell’autofagia in tali neuroni che sono stati creati dalle cellule della pelle dei pazienti di Huntington protegge quelle cellule dalla morte.
“Il nostro studio rivela come l’invecchiamento innesca una perdita del processo cruciale dell’autofagia e suggerisce come potremmo provare a ripristinare questa importante funzione, con l’obiettivo di ritardare o addirittura prevenire la malattia di Huntington”, ha affermato l’autore senior Andrew S. Yoo, Ph. .D., Professore di biologia dello sviluppo alla Washington University.
Lo studio, pubblicato il 27 ottobre sulla rivista Nature Neuroscience, potrebbe anche offrire indizi per comprendere il declino cognitivo nell’invecchiamento in generale.
La malattia di Huntington distrugge un tipo specifico di cellula cerebrale chiamata neuroni spinosi medi, la cui perdita provoca movimenti muscolari involontari, compromissione della salute mentale e declino cognitivo. I pazienti in genere vivono circa 20 anni dopo la comparsa dei primi segni della malattia.
Per questo studio, i ricercatori hanno riprogrammato le cellule della pelle dei pazienti in neuroni spinosi medi utilizzando una tecnica da loro sviluppata che consente alle cellule della pelle adulta di essere trasformate direttamente in vari tipi di cellule cerebrali, a seconda della ricetta specifica di molecole di segnalazione a cui le cellule della pelle sono esposto. Tecniche più comuni implicano l’uso di cellule staminali, ma le cellule staminali ripristinano gli orologi biologici delle cellule a uno stato di sviluppo precoce, il che non è utile quando si studiano malattie che diventano sintomatiche solo nell’età adulta.
“Abbiamo raccolto campioni di cellule della pelle da diversi pazienti in una gamma di età e modellato la malattia prima e dopo lo sviluppo dei sintomi, il che ci ha permesso di identificare le differenze tra i pazienti più giovani e quelli più anziani con malattia di Huntington“, ha detto Yoo. “Sapevamo che doveva esserci qualche cambiamento che si verifica quando i pazienti invecchiano. Tutti hanno una mutazione genetica nel gene Huntingtin. Volevamo trovare la differenza tra i pazienti giovani che non hanno sintomi e quelli più anziani che mostrano attivamente i segni della malattia”.
Vedi anche: SLA e Malattia di Huntington: CRISPR-Cas13 prende di mira le proteine mutanti
Yoo e i suoi colleghi, inclusi i co-primi autori Youngmi Oh, Ph.D., e Seongwon Lee, Ph.D., entrambi scienziati del laboratorio di Yoo, hanno scoperto nei neuroni spinosi medi riprogrammati dalle cellule della pelle di pazienti più anziani con sindrome di Huntington sintomatica, livelli molto alti di una molecola di microRNA chiamata miR-29b-3p.
Questi livelli elevati non sono stati osservati nei neuroni riprogrammati dei pazienti più giovani di Huntington o nei neuroni riprogrammati di individui sani di qualsiasi età. I ricercatori hanno dimostrato che il microRNA ha innescato una catena di eventi che includeva l’alterazione dell’autofagia in queste cellule. Quando le cellule della pelle hanno completato la conversione in neuroni, hanno iniziato a produrre il microRNA problematico, l’autofagia è rallentata e le cellule hanno iniziato a morire.
I ricercatori hanno poi dimostrato che la riduzione dei livelli di questo microRNA ha permesso all’autofagia di continuare il suo lavoro e ha protetto i neuroni dalla morte. Inoltre, hanno scoperto che potenziare l’autofagia con un composto chimico chiamato G2 proteggeva i neuroni malati dalla morte. Quando i ricercatori hanno aumentato la dose di G2, anche la protezione dalla morte cellulare è migliorata.
G2 è derivato da una serie di analoghi che sono stati scoperti nei laboratori dei coautori David Perlmutter, MD, vice-Cancelliere esecutivo per gli affari medici, George e Carol Bauer Dean della School of Medicine e Spencer T. e Ann W. Olin Illustre Professore; Gary Silverman, MD, Ph.D., il Professore Harriet B. Spoehrer e capo del Dipartimento di Pediatria e Stephen C. Pak, Ph.D., Professore di pediatria presso la Divisione di Medicina Neonato.
G2 è stato identificato tramite screening ad alto rendimento per farmaci potenziatori dell’autofagia che potrebbero correggere l’accumulo cellulare della variante alfa-1-antitripsina Z che causa malattie epatiche nel deficit di alfa-1-antitripsina (ATD). I composti G2 potrebbero quindi rappresentare candidati interessanti per prevenire la neurodegenerazione nella malattia di Huntington, la malattia del fegato nel deficit di alfa-1-antitripsina e forse altre malattie in cui l’accumulo aberrante di proteine mal ripiegate è tossico per le cellule.
Lo studio ha anche scoperto quello che potrebbe essere un indizio allettante per comprendere il declino cognitivo nell’invecchiamento normale. Confrontando i neuroni sintomatici con i neuroni presintomatici e con i neuroni sani di giovani e anziani, i ricercatori hanno scoperto che i neuroni degli anziani sani producevano livelli leggermente elevati del microRNA dannoso, ma in quantità molto inferiori rispetto ai neuroni dei pazienti con malattia di Huntington sintomatici.
Lo studio suggerisce che anche in un invecchiamento normale e sano, i neuroni spinosi medi producono gradualmente bassi livelli di questo microRNA, che possono interferire con la sana pulizia cellulare dell’autofagia.
“Modellando le diverse fasi della malattia nel corso della vita, possiamo identificare come l’invecchiamento gioca un ruolo nell’insorgenza della malattia”, ha detto Yoo.
“Con queste informazioni, possiamo iniziare a cercare modi per ritardare tale insorgenza. Il nostro studio suggerisce anche che la molecola scatenante per l’insorgenza della malattia di Huntington potrebbe svolgere un ruolo nel declino della funzione neuronale associato all’età in generale. Comprendere la componente dell’invecchiamento che innesca la neurodegenerazione può aiutare a sviluppare nuove strategie per il trattamento e la prevenzione della malattia di Huntington e di altre condizioni neurodegenerative che si sviluppano in età avanzata”, ha aggiunto Yoo.
Yoo e il suo team stanno anche lavorando con altri collaboratori utilizzando la loro tecnica di riprogrammazione cellulare per studiare forme di Alzheimer, tauopatia e altre condizioni neurodegenerative.
Fonte: Nature neuroscience