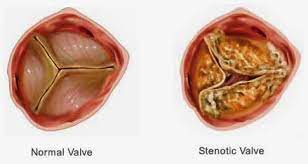
(Stenosi aortica-Immagine Credit Public Domain).
Uno studio condotto dalla Yale Unibversity fornisce nuove informazioni sullo sviluppo molecolare e cellulare della stenosi aortica sopravalvolare (SVAS), un raro difetto cardiaco congenito causato da mutazioni o delezione del gene dell’elastina e caratterizzato dal restringimento dell’aorta.
La ricerca, guidata dal Greif Lab dello Yale Cardiovascular Research Center, ha identificato il ruolo del gene Notch3 nella regolazione della proliferazione delle cellule muscolari lisce vascolari (SMC), la causa principale della stenosi durante la carenza di elastina. “I risultati di questo studio hanno anche implicazioni per altre condizioni che coinvolgono il danno dell’elastina, una causa diretta di irrigidimento vascolare e della sindrome di Williams-Beuren (WBS)”, hanno detto i ricercatori.

La carenza di elastina può ridurre i livelli di DNMT1. Illustrazione del laboratorio Greif. Credito immagine: Università di Yale
Il primo autore dello studio, Jui Dave, PhD, ricercatore associato presso la Yale School of Medicine, è stato anche il primo autore di uno studio precedente pubblicato sulla rivista Developmental Cell dal laboratorio dell’autore senior Daniel M. Greif, MD, Professore associato allo Yale School of Medicine, che ha identificato una proteina che ha dimostrato di contribuire all’emorragia cerebrale tra i neonati prematuri. In questo ultimo studio, Dave, Greif e colleghi si sono concentrati sul ruolo della via di segnalazione NOTCH, in particolare il ligando Jag1 e il recettore Notch3, nelle malattie cardiovascolari associate alla carenza di elastina.
Vedi anche:Stenosi aortica calcificata: potenziale nuova terapia
In un ambiente di laboratorio, Greif e il suo team hanno studiato modelli murini di carenza di elastina, SMC aortiche umane e SMC derivati da cellule staminali pluripotenti indotte di pazienti con SVAS e WBS. Hanno appreso che l’elastina ridotta nelle SMC attiva la segnalazione del percorso Notch3 tramite meccanismi epigenetici che alterano la struttura fisica del DNA per modulare l’attività genica.
I risultati suggeriscono che la carenza di elastina riduce i livelli di DNMT1, un enzima noto per metilare il DNA. La ridotta metilazione del DNA facilita l’attivazione genica, culminando in questo caso in un’eccessiva attivazione del percorso Notch3. Nei topi privi di elastina, il trattamento con un inibitore farmacologico della via Notch noto come DAPT, la delezione genetica di Notch3 o la delezione specifica SMC di Jag1 ha un effetto riparatore sulla parete aortica.
Con ulteriori studi, i ricercatori sperano di comprendere meglio la regolazione mediata dall’elastina dell’epigenoma SMC nello sviluppo vascolare e la patogenesi di altre malattie cardiovascolari legate al danno dell’elastina.
Fonte: Università di Yale