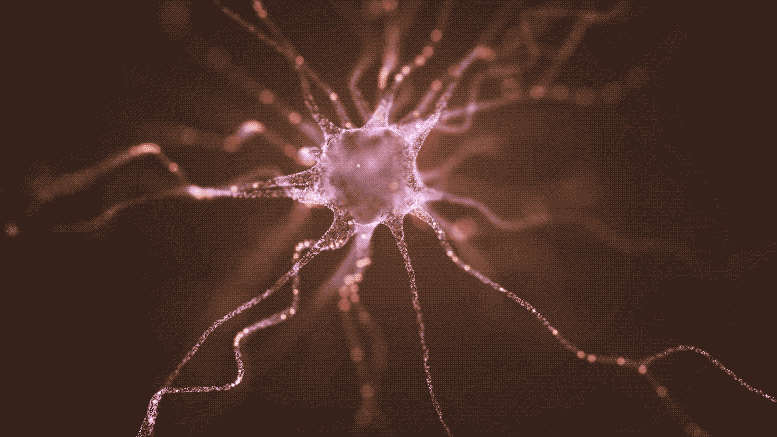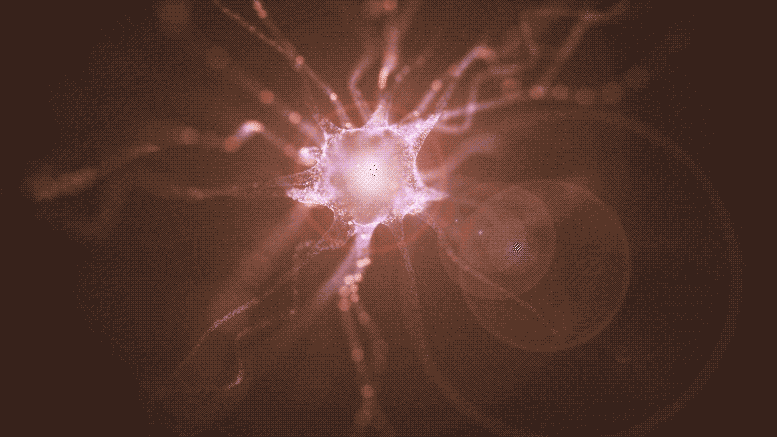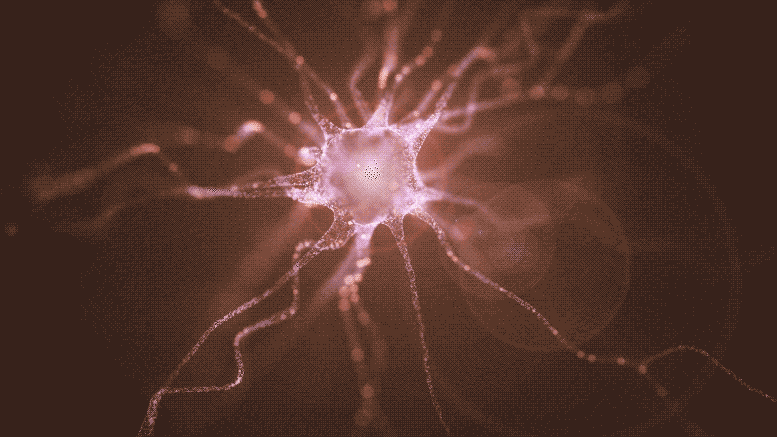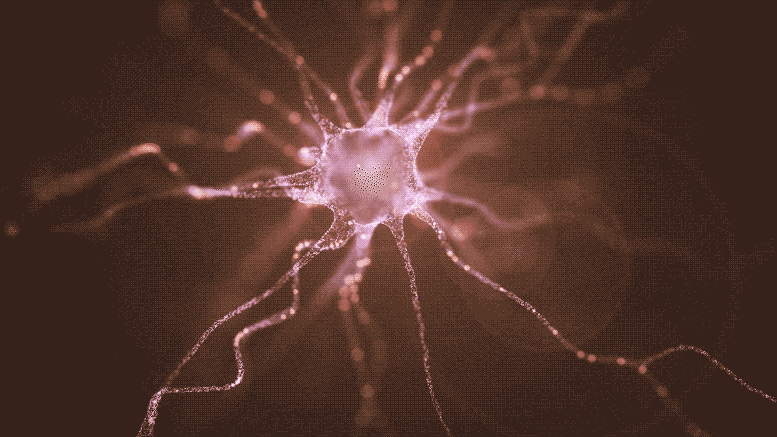
La nuova ricerca descrive l’impianto di cellule staminali pluripotenti indotte (iPSC) per sostituire i neuroni produttori di dopamina distrutti dal morbo di Parkinson. Tali cellule non solo sopravvivono alla procedura di innesto e producono dopamina, ma inviano le loro fibre ramificate attraverso il tessuto neurale per stabilire connessioni distanti nel cervello, proprio come le loro controparti naturali. Credito: Shireen Dooling per il Biodesign Institute dell’Arizona State University
(Parkinson.Immagine Credit Public Domani).
Le malattie neurodegenerative causano danni e distruzione neuronali, causando il caos sia sulla salute mentale che fisica. Il morbo di Parkinson, che colpisce oltre 10 milioni di persone in tutto il mondo, non fa eccezione. I sintomi più evidenti del morbo di Parkinson si verificano dopo che la malattia danneggia una specifica classe di neuroni localizzati nel mesencefalo. Il risultato è che la dopamina, un neurotrasmettitore chiave prodotto dai neuroni colpiti, è esaurita nel cervello.
In una nuova ricerca, Jeffrey Kordower e i suoi colleghi descrivono un metodo per convertire le cellule non neuronali in neuroni funzionanti in grado di stabilirsi nel cervello, inviare i loro rami fibrosi attraverso il tessuto neurale, formare sinapsi, dispensare dopamina e ripristinare le capacità compromesse dal morbo di Parkinson distruzione delle cellule dopaminergiche.
L’attuale studio proof-of-concept rivela che un gruppo di cellule ingegnerizzate sperimentalmente si comporta in modo ottimale in termini di sopravvivenza, crescita, connettività neurale e produzione di dopamina, quando impiantate nel cervello dei ratti. Lo studio dimostra che il risultato di tali innesti neurali è di invertire efficacemente i sintomi motori causati dal morbo di Parkinson.
Il lavoro è sostenuto da una sovvenzione della Michael J. Fox Foundation.
“Non possiamo essere più entusiasti dell’opportunità di aiutare le persone che soffrono di questa forma genetica del morbo di Parkinson, ma le lezioni apprese da questo studio avranno un impatto diretto anche sui pazienti che soffrono di forme sporadiche o non genetiche di questa malattia”, dice Kordower.
Vedi anche:Parkinson: come le proteine sono implicate nello sviluppo
Kordower dirige l’ASU-Banner Neurodegenerative Disease Research Center presso l’Arizona State University ed è Charlene e J. Orin Edson Distinguished Director presso il Biodesign Institute. Il nuovo studio descrive in dettaglio la preparazione sperimentale di cellule staminali adatte all’impianto per invertire gli effetti del morbo di Parkinson.
La ricerca appare nell’attuale numero della rivista Nature Regenerative Medicine.
Nuove prospettive sul morbo di Parkinson
Non devi essere un neuroscienziato per identificare un neurone. Tali cellule, con il loro pergolato ramificato di assoni e dendriti, sono immediatamente riconoscibili e non assomigliano a nessun altro tipo di cellula nel corpo. Attraverso i loro impulsi elettrici, esercitano un controllo meticoloso su tutto, dalla frequenza cardiaca al linguaggio. I neuroni sono anche il deposito delle nostre speranze e ansie, la fonte della nostra identità individuale.
La degenerazione e la perdita dei neuroni dopaminergici provoca i sintomi fisici di rigidità, tremore e instabilità posturale, che caratterizzano il morbo di Parkinson. Ulteriori effetti della malattia di Parkinson possono includere depressione, ansia, deficit di memoria, allucinazioni e demenza.
A causa dell’invecchiamento della popolazione, l’umanità sta affrontando una crisi crescente di casi di morbo di Parkinson, con numeri che dovrebbero aumentare a oltre 14 milioni a livello globale entro il 2040. Le attuali terapie, che includono l’uso del farmaco L-DOPA, sono in grado di affrontare solo alcuni dei sintomi motori della malattia e possono produrre effetti collaterali gravi, spesso intollerabili dopo 5-10 anni di utilizzo.
Non esiste un trattamento in grado di far regredire il morbo di Parkinson o di fermarne la progressione spietata. Sono assolutamente necessarie innovazioni lungimiranti per affrontare questa emergenza in sospeso.
Una (pluri) potente arma contro il Parkinson
Nonostante il fascino intuitivo di sostituire semplicemente le cellule morte o danneggiate per curare le malattie neurodegenerative, le sfide per impiantare con successo neuroni vitali per ripristinare la funzione sono formidabili. Molti ostacoli tecnici dovevano essere superati prima che i ricercatori, incluso Kordower, potessero iniziare a ottenere risultati positivi, utilizzando una classe di cellule note come cellule staminali.
L’interesse per le cellule staminali come terapia attraente per una serie di malattie ha rapidamente guadagnato slancio dopo il 2012, quando John B. Gurdon e Shinya Yamanaka hanno condiviso il Premio Nobel per la loro svolta nella ricerca sulle cellule staminali. Hanno dimostrato che le cellule mature possono essere riprogrammate, rendendole “pluripotenti” o in grado di differenziarsi in qualsiasi tipo di cellula del corpo.
Queste cellule staminali pluripotenti sono funzionalmente equivalenti alle cellule staminali fetali, che prosperano durante lo sviluppo embrionale, migrando verso il loro luogo di residenza e sviluppandosi in cuore, nervo, polmone e altri tipi di cellule, in una delle trasformazioni più notevoli in natura.
Alchimia neurale
Le cellule staminali adulte sono disponibili in due varietà. Un tipo può essere trovato nei tessuti completamente sviluppati come il midollo osseo, il fegato e la pelle. Queste cellule staminali sono in numero limitato e generalmente si sviluppano nel tipo di cellule appartenenti al tessuto da cui derivano.
Il secondo tipo di cellule staminali adulte (e oggetto di questo studio) è noto come cellule staminali pluripotenti indotte (iPSC). La tecnica per produrre le iPSC utilizzate nello studio avviene in due fasi. In un certo senso, le cellule sono indotte a viaggiare nel tempo, inizialmente in una direzione all’indietro e poi in una direzione in avanti.
In primo luogo, i globuli adulti vengono trattati con specifici fattori di riprogrammazione che li inducono a tornare alle cellule staminali embrionali. La seconda fase tratta queste cellule staminali embrionali con fattori aggiuntivi, inducendole a differenziarsi nelle cellule bersaglio desiderate: i neuroni produttori di dopamina.
“La scoperta principale nel presente documento è che la tempistica in cui si fornisce la seconda serie di fattori è fondamentale“, afferma Kordower. “Se li tratti e li coltivi per 17 giorni interrompi le loro divisioni e le differenzazioni e funzionano meglio”.
Attivare neuroni perfetti
Gli esperimenti dello studio includevano iPSC coltivati per 24 e 37 giorni, ma quelli coltivati per 17 giorni prima della loro differenziazione in neuroni dopaminergici erano notevolmente superiori, in grado di sopravvivere in numero maggiore e di inviare i loro rami a lunghe distanze. “Questo è importante”, dice Kordower, “perché dovranno crescere per lunghe distanze nel cervello umano più grande e ora sappiamo che queste cellule sono in grado di farlo”.
I ratti trattati con iPSC di 17 giorni hanno mostrato un notevole recupero dai sintomi motori del morbo di Parkinson. Lo studio dimostra inoltre che questo effetto è dose-dipendente. Quando un piccolo numero di iPSC è stato innestato nel cervello animale, il recupero è stato trascurabile, ma un ampio complemento di cellule ha prodotto ramificazioni neurali più abbondanti e una completa inversione dei sintomi del Parkinson.
La sperimentazione clinica iniziale applicherà la terapia iPSC a un gruppo di pazienti con morbo di Parkinson portatori di una particolare mutazione genetica, nota come mutazione di Parkin. Tali pazienti soffrono dei sintomi tipici della disfunzione motoria riscontrata nel Parkinson generale o idiopatico, ma non soffrono di declino cognitivo o di demenza. Questa coorte di pazienti fornisce un terreno di prova ideale per la terapia sostitutiva cellulare. Se il trattamento è efficace, seguiranno studi più ampi, applicando la strategia alla versione del Parkinson che colpisce la maggior parte dei pazienti.
Inoltre, il trattamento potrebbe potenzialmente essere combinato con le terapie esistenti per il trattamento del morbo di Parkinson. Una volta che il cervello è stato seminato con cellule sostitutive che producono dopamina, è possibile utilizzare dosi più basse di farmaci come la L-DOPA, mitigando gli effetti collaterali e migliorando i risultati benefici.
La ricerca pone le basi per la sostituzione di neuroni danneggiati o morti con cellule fresche per un’ampia gamma di malattie devastanti.
“I pazienti con la malattia di Huntington o con atrofia multisistemica o persino con il morbo di Alzheimer potrebbero essere trattati in questo modo per aspetti specifici del processo patologico”, afferma Kordower.
Fonte:Regenerative Medicine