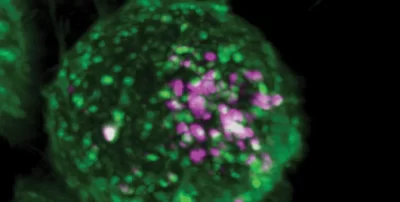
(Encefalite Equina-Immagine: particelle simili al virus dell’encefalite equina orientale (rosa) hanno mostrato di legarsi ed entrare nelle cellule (verde) che esprimono un recettore cellulare recentemente identificato. Illustrazione della struttura HMS MicRoN, per gentile concessione del laboratorio Abraham).
Un nuovo studio condotto dai ricercatori della Harvard Medical School ha identificato una serie di recettori cellulari per almeno tre alfavirus correlati condivisi tra zanzare, esseri umani e animali che ospitano il virus, utili per prepararci alle future pandemie possibili da encefalite equina.
Facendo un ulteriore passo avanti, i ricercatori hanno testato una molecola “esca” che ha prevenuto con successo l’infezione e rallentato la progressione della malattia in una serie di esperimenti su cellule e modelli animali, un primo passo importante verso lo sviluppo di farmaci preventivi e curativi contro questi virus altamente patogeni con potenziale pandemico .
I risultati sono stati pubblicati su Nature.
“Comprendere la biologia di base del ciclo di vita di un virus è fondamentale per trovare un modo per prevenire una malattia e costruire tali conoscenze di base prima di un focolaio è essenziale per prepararsi a futuri focolai”, ha affermato l’autore senior dello studio Jonathan Abraham, assistente Professore di microbiologia al Blavatnik Institute presso l’HMS e specialista in malattie infettive presso il Brigham and Women’s Hospital.
“Capire come un virus entra e infetta una cellula è fondamentale”, ha detto il ricercatore. “L’ingresso di virus nelle cellule umane o di altri mammiferi segna l’inizio dell’infezione e alla fine della malattia, ed è un ottimo punto di partenza per iniziare a cercare potenziali strategie preventive e farmaci curativi”.
“Gli alfavirus studiati dai ricercatori, compreso l’EEEV, hanno una storia di responsabilità in focolai mortali, anche se di breve durata, ma si sa poco su come il virus attacchi le cellule ospiti. Sono stati identificati solo pochi altri recettori correlati all’infezione da alfavirus. Questa lacuna di conoscenza è una delle ragioni della mancanza di trattamenti mirati per questi virus letali”, ha detto Abraham.
Zanzare infette
L’encefalite equina orientale (tripla E) si diffonde tipicamente all’uomo dal morso di una zanzara infetta. L’epidemia di tripla E più recente si è verificata nel New England nel 2019. L’epidemia di tripla E ha ricoverato in Ospedale tutti i 32 casi noti e ucciso 12 di quelli infetti, secondo un rapporto dei Centers for Disease Control and Prevention degli Stati Uniti sull’epidemia di tripla E del 2019 .
Il virus ha un tasso di mortalità del 30%, il che significa che uccide quasi un terzo di coloro a cui è stata diagnosticata la malattia, paragonabile alla malattia da virus Ebola o al vaiolo.
“Quasi la metà di coloro che sopravvivono sperimenta complicazioni neurologiche a lungo termine dovute alla malattia, secondo il CDC. Focolai più grandi si sono verificati negli anni ’30 e ’50, ma la raccolta dei dati e la diagnostica sono cambiate così tanto da allora che è difficile confrontare l’entità dei focolai”, osserva il rapporto del CDC.
“Ci sono grandi vantaggi nel fare questo lavoro prima dell’inizio di gravi epidemie”, ha affermato Abraham, che ha lavorato all’identificazione dei recettori che i virus utilizzano come percorsi per entrare nelle cellule e causare malattie e sullo sviluppo di trattamenti anticorpali per prevenire l’infezione da SARS-CoV-2 e COVID-19.
Vedi anche:Il virus dellìencefalite equina dell’Est rappresenta una minaccia emergente
Ad esempio, il lavoro precedente su SARS-CoV durante l’epidemia di SARS dei primi anni 2000 è stato fondamentale per aumentare la preparazione contro SARS-CoV-2. La disponibilità delle sequenze del genoma SARS-CoV-2 entro pochi giorni dalla segnalazione iniziale del nuovo virus è stata fondamentale per il rapido sviluppo di vaccini e trattamenti anticorpali per COVID-19, poiché i virus strettamente correlati che causano COVID-19 e SARS attaccano entrambi ospiti umani utilizzando lo stesso recettore sulle cellule umane per ottenere l’ingresso e causare malattie.
“Nuovi strumenti e tecniche di screening in biologia molecolare, biochimica delle proteine, biofisica e biologia strutturale, forniscono un potere senza precedenti per conoscere più che mai la biologia di base dei virus prima che emergano come minacce globali”, ha affermato Abraham.
“Il momento di prepararsi a questi scenari incerti, ma potenzialmente catastrofici non è quando si verificano, ma molto prima che accadano”, ha detto Abraham.
Schermo di modifica genetica CRISPR-Cas9
Per il presente studio, i ricercatori hanno utilizzato per la prima volta uno schermo di modifica genetica CRISPR-Cas9 per identificare un recettore per il virus della foresta Semliki (SFV) sulle cellule umane. SFV è un alfavirus che può causare gravi malattie neurologiche e morte nei roditori e in altri animali.
I recettori che i ricercatori hanno trovato per SFV erano anche compatibili con EEEV e un altro virus correlato chiamato Sindbis, che può causare febbre e forti dolori articolari negli esseri umani e provoca malattie neurologiche negli animali e nei roditori
“Ecco perché è importante studiare questi virus come famiglie”, ha detto Abraham. “Puoi finire per studiare un virus come SFV e scoprire qualcosa di veramente eccitante sulla biologia dei virus correlati che ha il potenziale per sbloccare nuovi modi per trattare nuove categorie di virus che sono in grado di causare gravi malattie ed epidemie negli esseri umani”.
“L’identificazione di un recettore per più virus darebbe a scienziati e medici la possibilità di sviluppare strumenti per prevenire, controllare e curare le infezioni in caso di focolaio di uno dei virus”, ha affermato Abraham.
Per verificare che i recettori in questione fossero importanti nel causare l’infezione, i ricercatori hanno condotto esperimenti con una proteina esca, una molecola con una struttura che imita il recettore e può indurre il virus a legarsi al farmaco invece che alla cellula ospite ha lo scopo di infettare. La molecola, in effetti, disabilita il virus ed evita l’ingresso nella cellula ospite, prevenendo l’infezione.
Gli esperimenti del team hanno dimostrato che il blocco dell’interazione del virus con il recettore della cellula ospite ha impedito l’infezione dei neuroni umani e del topo.
I ricercatori hanno anche scoperto che la molecola esca proteggeva i topi infetti dallo sviluppo di encefalite da alfavirus rapidamente fatale, una scoperta che secondo i ricercatori suggerisce che questo percorso potrebbe essere preso di mira da farmaci o anticorpi per trattare l’encefalite da alfavirus negli esseri umani quando si verificano infezioni.
I ricercatori avvertono di aver condotto i loro studi sugli animali con il virus della foresta di Semliki e non con l’EEEV, quindi sarebbero necessari ulteriori esperimenti per verificare che lo stesso approccio potrebbe funzionare per diversi alfavirus e nell’uomo.
Trasformare un’intuizione di base come questa in uno strumento clinico di solito richiede anni. I ricercatori devono assicurarsi che sia sicuro ed efficace e devono trovare il modo migliore per somministrare le molecole esca. “Per guadagnare tanto tempo in anticipo per prepararsi ai virus emergenti, è fondamentale costruire questa base di conoscenze prima della prossima pandemia”, ha affermato Abraham.
“Tutti noi – scienziati, politici e cittadini – trarremmo grandi benefici dall’imparare a essere più lungimiranti”, ha detto Abraham. “Più sappiamo sulla biologia di base delle diverse famiglie di virus, in particolare su come infettano e interagiscono con i loro ospiti, meglio saremo preparati ad affrontare qualunque cosa accada”.
Fonte: HMS