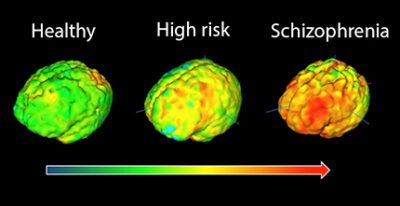
(Schizofrenia-Immagine Credit Public Domain).
Diversi cambiamenti nelle cellule cerebrali durante il primo mese di sviluppo embrionale possono contribuire alla schizofrenia più avanti nella vita, secondo un nuovo studio dei ricercatori di Weill Cornell Medicine.
I ricercatori, il cui studio è stato pubblicato su Molecular Psychiatry il 17 novembre, hanno utilizzato cellule staminali raccolte da pazienti con schizofrenia e persone senza la malattia per far crescere “mini-cervelli” tridimensionali o organoidi in laboratorio. Confrontando lo sviluppo di entrambi i gruppi di organoidi, hanno scoperto che una ridotta espressione di due geni nelle cellule ostacola lo sviluppo precoce e provoca una carenza di cellule cerebrali negli organoidi cresciuti da cellule staminali dei pazienti.
“Questa scoperta colma un’importante lacuna nella comprensione della schizofrenia da parte degli scienziati“, ha affermato l’autore senior Dr. Dilek Colak, assistente Professore di neuroscienze presso il Feil Family Brain and Mind Institute e il Center for Neurogenetics presso Weill Cornell Medicine. I sintomi della schizofrenia si sviluppano tipicamente nell’età adulta, ma gli studi post mortem sul cervello delle persone con la malattia hanno trovato cavità allargate chiamate ventricoli e differenze negli strati corticali che probabilmente si sono verificate all’inizio della vita.
“Ci sono stati indizi che la schizofrenia sia iniziata durante lo sviluppo embrionale, ma non avevamo trovato prove”, ha detto il Dott. Colak.
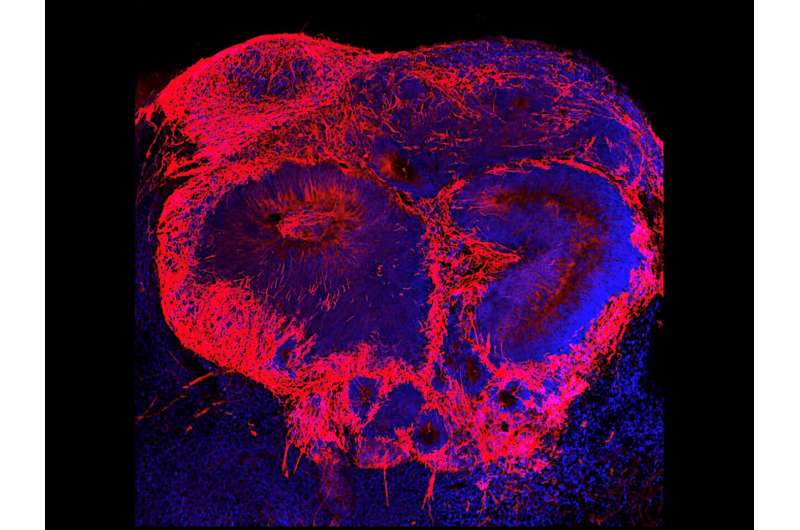
Coltivando organoidi da cellule staminali raccolte da un massimo di 21 donatori di cellule staminali umane, il team, guidato dal primo autore Dr. Michael Notaras, un ex NHMRC CJ Martin Fellow nel laboratorio del Dr. Colak, è stato in grado di far crescere il tessuto cerebrale con l’esatto corredo genetico. Quindi, i ricercatori hanno usato il sequenziamento dell’RNA di una singola cellula per confrontare l’espressione genica nelle singole cellule nel tessuto del paziente e nel tessuto cresciuto da persone senza schizofrenia.
Vedi anche:Schizofrenia: nuovo approccio per il trattamento
“Abbiamo trovato una patologia comune tra tutti i pazienti con schizofrenia, nonostante ciascuno dei pazienti avesse presentazioni di malattia distinte”, ha detto il Dott. Colak.
I campioni di pazienti affetti da schizofrenia avevano una ridotta espressione di due geni essenziali per lo sviluppo del cervello, un regolatore dell’espressione genica chiamato BRN2 e un promotore della crescita cellulare chiamato pleiotropina. Ciò ha portato a una riduzione della produzione di nuove cellule cerebrali e ad un aumento della morte delle cellule cerebrali. La sostituzione del BRN2 mancante nelle cellule ha ripristinato la produzione di cellule cerebrali, mentre l’aggiunta di pleiotropina ha ridotto la morte delle cellule cerebrali. Se più studi confermeranno questi risultati, potrebbero portare allo sviluppo di terapie mirate che aiutano a correggere queste differenze genetiche in specifici tipi di cellule cerebrali.
“Abbiamo fatto una scoperta fondamentale fornendo quella che pensiamo sia la prima prova nel tessuto umano che esistono più meccanismi cellulari specifici e che probabilmente contribuiscono al rischio di schizofrenia“, ha affermato il dott. Notaras. “Questo ci costringe a riconsiderare l’inizio dello sviluppo della malattia e come dovremmo pensare allo sviluppo della prossima generazione di terapie per la schizofrenia”.
Spiegano gli autori:
“A causa dell’inpossibilità di accedere eticamente al tessuto cerebrale umano in via di sviluppo e di identificare i casi potenziali, le firme dello sviluppo neurologico e cellulare specifiche della schizofrenia (Scz) sono rimaste sconosciute e quindi indefinite. Per superare queste sfide, abbiamo utilizzato cellule staminali pluripotenti indotte (iPSC) derivate dal paziente per generare organoidi cerebrali 3D per modellare la neuropatologia della Scz durante questo periodo critico. Abbiamo scoperto che gli organoidi di Scz mostravano neuropatologia ventricolare con conseguente sopravvivenza dei progenitori alterata e neurogenesi interrotta. Questo alla fine ha prodotto un minor numero di neuroni all’interno dello sviluppo di campi corticali di organoidi Scz. Il sequenziamento di una singola cellula ha rivelato che i progenitori Scz erano specificamente impoveriti di fattori di programmazione neuronale che portavano a un rimodellamento delle linee cellulari, traiettorie di differenziazione alterate, e la diversità distorta del tipo di cellula corticale. Mentre gli organoidi Scz erano simili nella loro diversità macromolecolare agli organoidi generati da controlli sani (Ctrls), quattro fattori GWAS (PTN, COMT, PLCL1 e PODXL) e frammenti peptidici appartenenti alla famiglia dei fattori di trascrizione del dominio POU (ad esempio, POU3F2/BRN2 ) sono stati modificati. Ciò ha rivelato che gli organoidi Scz differivano principalmente non nella loro diversità proteomica, ma in particolare nella quantità totale di malattie e fattori di sviluppo neurologico a livello molecolare. Il sequenziamento di una singola cellula ha successivamente identificato alterazioni specifiche del tipo cellulare nei fattori di programmazione neuronale, nonché un interruttore di sviluppo nell’espressione del fattore di crescita neurotrofico, indicando che la neuropatologia di Scz può essere codificata su una base tipo di cellula per tipo di cellula. Inoltre, il sequenziamento di una singola cellula ha anche replicato in modo specifico l’esaurimento di BRN2 (POU3F2) e PTN sia nei progenitori Scz che nei neuroni. Successivamente, in due esperimenti di salvataggio meccanicistico abbiamo identificato che il fattore di trascrizione BRN2 e il fattore di crescita PTN operano come substrati meccanicistici della neurogenesi e della sopravvivenza cellulare, rispettivamente, negli organoidi di Scz. Collettivamente, il nostro lavoro suggerisce che esistono molteplici meccanismi di Scz negli organoidi derivati dal paziente e che questi meccanismi disparati convergono su percorsi di sviluppo cerebrale primordiale come la differenziazione neuronale, la sopravvivenza e il supporto del fattore di crescita, che possono amalgamarsi per elevare il rischio intrinseco di Scz”.
La Dr.ssa Colak e i suoi colleghi stanno attualmente usando i mini-cervelli per iniziare a comprendere il ruolo dei singoli tipi di cellule e per capire meglio come i fattori genetici possono interagire con l’ambiente per causare la schizofrenia. Si stanno concentrando sul ruolo delle cellule endoteliali, cellule che tipicamente rivestono i vasi sanguigni e rilasciano importanti molecole immunitarie chiamate citochine. I mini-cervelli cresciuti da pazienti con schizofrenia avevano un eccesso di cellule endoteliali precoci, che potevano portare a un’eccessiva risposta immunitaria all’infezione.
“Questo potrebbe spiegare il legame tra le infezioni materne durante la gravidanza e la schizofrenia osservata negli studi sui topi”, ha detto il Dott. Colak.
Oltre ad aiutare gli scienziati a comprendere meglio la schizofrenia, la Dr.ssa Colak ha riferito che i mini-cervelli cresciuti dalle cellule staminali dei pazienti possano essere uno strumento utile per studiare altre malattie del cervello.
“La tecnica potrebbe essere utilizzata per studiare la patologia precoce delle malattie neuropsichiatriche o neurodegenerative a esordio tardivo come il morbo di Alzheimer o la malattia di Huntington”, ha detto il Dott. Colak.
Fonte:Nature