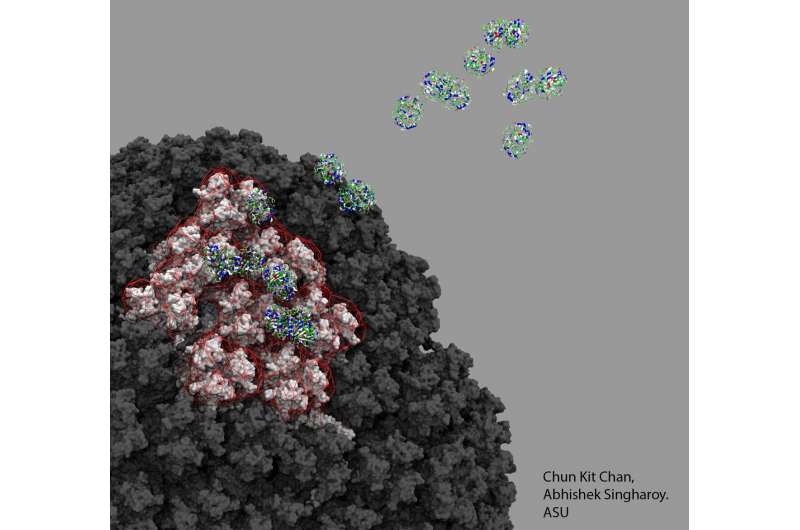
(Vaccini COVID 19-Immagine: nuvola di proteine del fattore 4 delle piastrine che interagiscono con la superficie elettrostatica del vaccino di Oxford, vista attraverso il microscopio computazionale. Credito: Chun Kit Chan, Arizona State University).
Un team internazionale di scienziati ritiene di aver trovato un meccanismo molecolare dietro i rarissimi coaguli di sangue legati ai vaccini COVID-19 a base di adenovirus.
Scienziati guidati da un team dell’Arizona State University, dell’Università di Cardiff e altri hanno lavorato con AstraZeneca per indagare sulla trombocitopenia indotta da vaccino (VITT), nota anche come trombosi con sindrome da trombocitopenia (TTS), una condizione pericolosa per la vita osservata in un piccolissimo numero di persone dopo aver ricevuto i vaccini Oxford-AstraZeneca o Johnson & Johnson.
“Il meccanismo che provoca questa condizione, chiamata trombocitopenia immune trombotica indotta dal vaccino (VITT), era sconosciuto”, ha detto Abhishek Singharoy, uno scienziato dell’Arizona State University e autore corrispondente dello studio. “Quindi, un team di ricercatori si è rapidamente radunato per cercare di comprendere più chiaramente il problema”.
Insieme, i ricercatori hanno lavorato per risolvere la biologia strutturale del vaccino e vedere i dettagli molecolari che potrebbero essere in gioco, utilizzando le nuove strutture crio-EM dell’ASU e una macchina Titan Krios all’avanguardia presso l’Eyring Materials Center dell’ASU a Università statale dell’Arizona.
Gli scienziati dell’ASU includevano diversi scienziati della School of Molecular Sciences and Biodesign Institute: Ryan J. Boyd, Daipayan Sarkar, John Vant, Eric Wilson, Chloe D. Truong, Petra Fromme, Po-Lin Chiu, Dewight Williams e Josh Vermaas (alunno dell’ASU ora alla Michigan State University). Anche Mitesh Borad, Bolni M. Nagalo e Alexander T. Baker facevano parte del team con sede in Arizona.
Il team ha utilizzato la tecnologia crio-EM all’avanguardia per analizzare il vaccino COVID 19 di AstraZeneca nei minimi dettagli per capire se l’effetto collaterale ultra raro dei coagulu potrebbe essere collegato al vettore virale utilizzato in molti vaccini, compresi i vaccini Oxford /AstraZeneca e Johnson & Johnson.
I risultati suggeriscono che è il vettore virale, in questo caso un adenovirus utilizzato per trasportare il materiale genetico del coronavirus nelle cellule, e il modo in cui si lega al fattore piastrinico 4 (PF4) una volta iniettato, che potrebbe essere il potenziale meccanismo.
“In casi molto rari”, suggeriscono gli scienziati, “il vettore virale può entrare nel flusso sanguigno e legarsi a PF4, dove il sistema immunitario vede questo complesso come estraneo”. I ricercatori ritengono che questa immunità malriposta potrebbe comportare il rilascio di anticorpi contro PF4, che si legano e attivano le piastrine, facendole raggruppare insieme e innescando coaguli di sangue in un numero molto ridotto di persone dopo la somministrazione del vaccino.
“È davvero fondamentale studiare a fondo le interazioni vettore-ospite del vaccino a livello meccanicistico”, ha affermato Singharoy. “Ciò aiuterà a capire sia come il vaccino generi immunità, sia come possa portare a eventi avversi rari, come VITT“.
I risultati dello studio sono stati pubblicati oggi sulla rivista internazionale Science Advances.
Il Professor Alan Parker, esperto nell’uso di adenovirus per applicazioni mediche presso la School of Medicine dell’Università di Cardiff, ha dichiarato: “VITT si verifica solo in casi estremamente rari perché è necessario che si verifichi una catena di eventi complessi per innescare questo effetto collaterale ultra raro. I nostri dati confermano che PF4 può legarsi agli adenovirus, un passo importante per svelare il meccanismo alla base della VITT. Stabilire un meccanismo potrebbe aiutare a prevenire e curare questo disturbo”.
“Speriamo che i nostri risultati possano essere utilizzati per comprendere meglio i rari effetti collaterali di questi nuovi vaccini e potenzialmente per progettare vaccini nuovi e migliorati per invertire la rotta di questa pandemia globale”. Quando entrambi i vaccini hanno mostrato l’effetto collaterale ultra raro di VITT, gli scienziati si sono chiesti se il vettore virale avesse qualche ruolo da svolgere in questa situazione. Un altro indizio importante è che né i vaccini Moderna né quelli Pfizer, realizzati con una tecnologia completamente diversa chiamata vaccini a mRNA, hanno mostrato questo effetto.
Il team ha utilizzato la tecnologia cryo-EM per congelare i preparati di ChAdOx1, l’adenovirus utilizzato nel vaccino AstraZeneca, e bombardarli con elettroni per produrre immagini microscopiche dei componenti del vaccino.
I ricercatori sono stati quindi in grado di esaminare a livello atomico la struttura della gabbia proteica esterna del virus, il capside virale, e altre proteine critiche che consentono l’ingresso del virus nella cellula.
In particolare, il team ha delineato i dettagli per la struttura e il recettore di ChAdOx1, che è adattato dall’adenovirus Y25 dello scimpanzé e come interagisce con PF4. Credono che sia questa interazione specifica, e il modo in cui viene poi presentata al sistema immunitario, che potrebbe indurre le difese dell’organismo a considerarla estranea e a rilasciare anticorpi contro questa auto-proteina.
Vedi anche:Vaccini COVID 19 e calo della protezione
Il team di ricerca ha anche utilizzato i modelli computazionali di Singharoy per dimostrare che uno dei modi in cui le due molecole si legano strettamente è tramite interazioni elettrostatiche. Il gruppo ha mostrato che ChAdOx1 è per lo più elettronegativo. Questo fa sì che la proteina agisca come l’estremità negativa di un terminale della batteria e potrebbe attrarre altre molecole cariche positivamente sulla sua superficie.
Il primo autore dello studio, il Dott. Alexander Baker, ha dichiarato: “Abbiamo scoperto che ChAdOx1 ha una forte carica negativa. Ciò significa che il vettore virale può agire come un magnete e attirare proteine con la carica opposta, positiva, come PF4″. Baker è membro del Biodesign Center for Applied Structural Discovery dell’ASU e ricercatore onorario presso la Cardiff University School of Medicine.
“Abbiamo quindi scoperto che PF4 ha le dimensioni e la forma giuste che quando si avvicina a ChAdOx1 potrebbe legarsi tra le parti caricate negativamente della superficie di ChAdOx1, chiamate esoni“.
Il team di ricerca spera che una migliore comprensione di ciò che potrebbe causare la rara VITT, possa fornire ulteriori informazioni su come i vaccini e altre terapie, che si basano sulla stessa tecnologia, potrebbero essere modificati nello sviluppo di vaccini e terapie di prossima generazione. .
“Con una migliore comprensione del meccanismo con cui interagiscono PF4 e adenovirus c’è l’opportunità di progettare il guscio del vaccino, il capside, per prevenire questa interazione con PF4. Modificare ChAdOx1 per ridurre la carica negativa può ridurre la possibilità di causare trombosi con la sindrome da trombocitopenia”, ha detto Baker.
I contatti chiave dei singoli amminoacidi che sono essenziali per l’interazione delle proteine del capside con PF4 possono essere rimossi o sostituiti.
“La modifica degli esoni ChAdOx1 per ridurre la loro elettronegatività può risolvere due problemi contemporaneamente: ridurre la propensione a causare VITT a livelli ancora più bassi e ridurre i livelli di immunità preesistente, contribuendo così a massimizzare l’opportunità di indurre risposte immunitarie robuste”, dice dice Singharoy.”Sia l’Agenzia di regolamentazione dei medicinali e dei prodotti sanitari (MHRA) con sede nel Regno Unito che i Centri per il controllo e la prevenzione delle malattie (CDC) negli Stati Uniti continuano a consigliare la vaccinazione che è il modo migliore per proteggere le persone da COVID-19 e i benefici superano di gran lunga il rischio di eventuali effetti collaterali noti.
Fonte: Science Advances