(Metformina-Immagine: gli scienziati riferiscono che la metformina, usata per trattare il diabete mellito di tipo 2, induce l’attivazione e la proliferazione dei linfociti T CD8+ bersaglio del tumore (CD8TIL), attraverso meccanismi che coinvolgono la generazione di specie reattive dell’ossigeno nei mitocondri di CD8TIL e un aumento della glicolisi. Credito: Heiichiro Udono, Università di Okayama).
La medicina moderna ha compiuto lenti progressi nella lotta contro la minaccia del cancro. Con tutte le mutazioni e le combinazioni del cancro che colpiscono milioni di persone in tutto il mondo, una terapia globale, ma mirata sarebbe l’ideale. Recentemente, è stato scoperto che alcuni farmaci come la metformina, usata per trattare malattie legate allo stile di vita come il diabete mellito di tipo 2, hanno effetti antitumorali. L’uso della metformina sembra rafforzare l’immunità antitumorale. Tuttavia, i meccanismi immunologici sottostanti sono sfuggiti agli scienziati fino ad oggi.
Gli scienziati giapponesi guidati dal Professor Heiichiro Udono dell’Università di Okayama hanno quindi deciso di affrontare questo interrogativo della ricerca oncologica. Nel loro recente studio, hanno esaminato come un sottoinsieme specifico di cellule immunitarie, chiamato linfociti T infiltranti CD8+ (CD8TIL), che attaccano specificamente le cellule tumorali, si è comportato in risposta alla metformina.
I loro risultati sono stati pubblicati sul Journal for ImmunoTherapy of Cancer.
Il Prof. Udono, che ha guidato lo studio, ha quasi rinunciato alle sue ricerche contro il cancro quando ha perso suo padre a causa del cancro. Tuttavia, l’ispirazione è arrivata a bussare alla sua porta ad una conferenza. Dice il ricedrcatore: “Quasi 10 anni fa, un interruttore si è acceso nella mia testa quando ho partecipato a un simposio Keystone sul cancro e l’ipossia, tenutosi a Banff, in Alberta. Mi sono reso conto che avevamo perso l’Effetto Warburg, un effetto che rafforza la crescita del cancro, nella nostra precedente ricerca. Quindi riportare l’effetto Warburg a un normale profilo metabolico nei tumori è diventato un argomento che mi ha fatto pensare. Sorprendentemente, ho ricevuto un suggerimento dalla stessa conferenza che la metformina potrebbe aiutare l’immunità al cancro. Quindi ci siamo messi al lavoro“.
Il Prof. Udono e il suo team hanno eseguito meticolosamente una serie di esperimenti su linee cellulari cancerose e un modello murino knock-out, di possibili biomolecole che determinano un’immunità antitumorale metformina-dipendente. Per arrivare ai loro risultati, hanno sondato i meccanismi intracellulari in CD8TIL quando esposti a metformina e valutato diversi biomarcatori per la crescita. Dato che CD8TIL produce proteine chiamate interferoni per attaccare le cellule tumorali, hanno anche valutato i livelli corrispondenti.
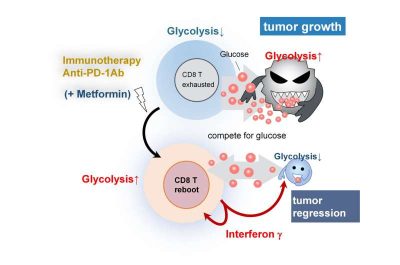
Di conseguenza, gli scienziati hanno scoperto che la metformina provoca la generazione di specie reattive dell’ossigeno nei mitocondri di CD8TIL (mtROS) e aumenta la glicolisi. Inoltre, hanno scoperto che mtROS ha attivato percorsi di crescita in CD8TIL, consentendo così la proliferazione di queste cellule immunitarie. In particolare, questo si ottiene attraverso un fattore di trascrizione coinvolto nella risposta allo stress ossidativo, chiamato Nrf. Inoltre, hanno anche escluso che la metformina provochi un effetto antitumorale attraverso l’apoptosi e hanno determinato che la metformina ha indotto CD8TIL a secernere in modo robusto interferone-ɣ per alterare il microambiente tumorale per favorire la morte delle cellule tumorali.
Vedi anche:La metformina riduce la gravità e la mortalità in COVID 19
Spiegano gli autori:
“La metformina (Met) è il trattamento di prima linea per il diabete mellito di tipo 2 e svolge un ruolo efficace nel trattamento di varie malattie, come le malattie cardiovascolari, le malattie neurodegenerative, il cancro e l’invecchiamento. Tuttavia, il meccanismo alla base dell’immunità antitumorale dipendente da Met resta da chiarire. MitoTEMPO, uno scavenger del superossido mitocondriale, ha abolito l’effetto antitumorale del Metformina, ma non il trattamento con anticorpi anti-morte cellulare antiprogrammata (PD-1) (Ab). Di conseguenza, abbiamo studiato il meccanismo dell’effetto antitumorale indotto dalla Metformina. Espressioni del trasportatore del glucosio (Glut)-1, specie reattive dell’ossigeno mitocondriale (mtROS), interferone (IFN)-γ, Ki67, marcatori di autofagia, marcatori di attivazione per il fattore 2 correlato a NF-E2 (Nrf2) e bersaglio del complesso rapamaycina nei mammiferi 1 (mTORC1) in CD8 +i linfociti T infiltranti il tumore (CD8TILs), sono stati esaminati mediante analisi di citometria a flusso. Inoltre, sono stati utilizzati topi knockout condizionali per Nrf2 e p62 per rilevare questi marcatori, insieme al monitoraggio della crescita tumorale in vivo. Il sequenziamento dell’RNA è stato eseguito per CD8TIL e cellule tumorali. Le cellule di melanoma contenenti un mutante di delezione del dominio citoplasmatico del recettore IFN-γ (IFNγR) sono state sovraespresse e utilizzate per la caratterizzazione del profilo metabolico di quelle cellule tumorali utilizzando un Seahorse Flux Analyzer.
La somministrazione di Met eleva mtROS e Glut-1 sulla superficie cellulare, con conseguente produzione di IFN-γ nei CD8TIL. mtROS attiva Nrf2 in modo dipendente dalla glicolisi, inducendo l’attivazione di autofagia, glutaminolisi, mTORC1 e p62/SQSTM1. Anche la fosforilazione mTORC1-dipendente di p62 a serina 351 (p-p62(S351)) è coinvolta nell’attivazione di Nrf2. La delezione condizionale di Nrf2 nei CD8TIL annulla l’attivazione di mTORC1 e l’immunità antitumorale da parte di Met. In sinergia con l’effetto dell’anti-PD-1 Ab, Met aumenta la proliferazione di CD8TIL e la secrezione di IFN-γ, con conseguente diminuzione della glicolisi e della fosforilazione ossidativa nelle cellule tumorali. Di conseguenza, Glut-1 è elevato nei CD8TIL, insieme all’espansione delle cellule dendritiche attivate. Inoltre, le cellule tumorali prive di segnalazione di IFNγR aboliscono la produzione di IFN-γ e la proliferazione di CD8TIL. Abbiamo scoperto che Met stimola la produzione di mtROS, che innesca l’elevazione di Glut-1 e l’attivazione di Nrf2 nei CD8TIL. Nrf2 attiva mTORC1, mentre mTORC1 attiva Nrf2 in modo dipendente da p-p62(S351), creando così un ciclo di feedback che assicura la proliferazione dei CD8TIL. In combinazione con anti-PD-1 Ab, Met stimola una robusta proliferazione di CD8TIL e secrezione di IFN-γ, con conseguente riprogrammazione IFN-γ-dipendente del microambiente tumorale”.
Parlando dei risultati, il Prof. Udono esclama: “Più di ogni altra cosa, il nostro studio fornisce la conoscenza che possiamo proteggere il nostro corpo dal cancro. Speriamo che questa comprensione si traduca non solo nella riduzione dell’incidenza del cancro e nel miglioramento del trattamento, ma aiuterà anche a prolungare la vita”. I ricercatori aggiungono anche che questi risultati suggeriscono fortemente la possibilità di utilizzare la metformina come farmaco per rafforzare l’immunità antitumorale nei pazienti con cancro.