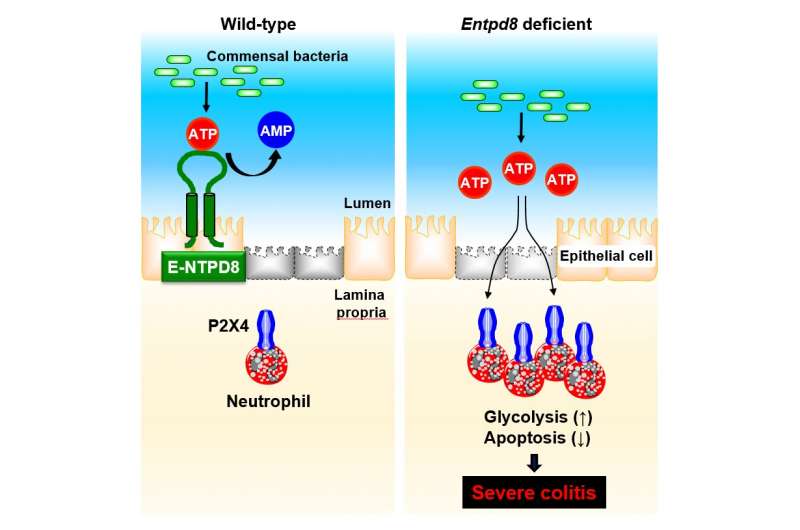
(Colite-Immagine: E-NTPD8 nelle cellule epiteliali del colon mantiene l’omeostasi intestinale attraverso l’idrolisi dell’ATP luminale prodotto dai batteri commensali (a sinistra). Un aumento del livello di ATP luminale causato da una mancanza di E-NTPD8 modula la fisiologia dei neutrofili, come la sopravvivenza prolungata attraverso la promozione della glicolisi mediata da P2X4. Questo può quindi aggravare i sintomi della colite (a destra). Credito: Haruka Tani et al.).
L’ecosistema microbico intestinale comprende diverse specie di batteri. Questi batteri possono produrre metaboliti bioattivi che influenzano direttamente il sistema immunitario dell’ospite. Uno squilibrio dei metaboliti microbici è stato implicato nella patogenesi dei disturbi cronici, inclusa la colite ulcerosa. In un recente articolo pubblicato su PNAS, un team guidato da ricercatori dell’Università di Osaka ha scoperto un meccanismo molecolare mediante il quale l’aggravamento della colite viene inibito attraverso la regolazione dei livelli intestinali di un metabolita microbico, l’adenosina trifosfato (ATP), che colpisce alcune cellule immunitarie e facilita risposte infiammatorie.
Poiché l’ATP secreto dai batteri nell’intestino, noto come ATP luminale, influenza il sistema immunitario dell’ospite, la quantità di ATP luminale è strettamente controllata per prevenire l’infiammazione intestinale. Tuttavia, il meccanismo specifico per la regolazione dei livelli di ATP luminale nel colon non è completamente compreso. Il gruppo di ricerca ha studiato il ruolo di un enzima che idrolizza l’ATP, chiamato ectonucleoside trifosfato difosfoidrolasi 8 (E-NTPD8), nel colon.
Gli enzimi appartenenti alla famiglia E-NTPD possono scomporre le molecole di ATP in adenosina difosfato o adenosina monofosfato, un processo che viene definito idrolisi dell’ATP, per bloccare risposte immunitarie inadeguate. I ricercatori hanno eseguito esperimenti di coltura cellulare e hanno scoperto che E-NTPD8 può idrolizzare l’ATP aggiunto al mezzo di coltura cellulare. Per studiare l’impatto specifico di questa attività in vivo, hanno generato un sistema modello con topi privi del gene che codifica per la proteina E-NTPD8.
“Nei topi knockout, l’espressione di E-NTPD8 è stata completamente abolita nelle cellule epiteliali del colon, mentre i topi wild type avevano un’alta espressione di questa proteina in queste cellule”, afferma l’autore senior Kiyoshi Takeda. “C’erano anche livelli molto più alti di ATP luminale nei topi knockout”.
Inoltre, dopo aver indotto chimicamente la colite, il team ha osservato sintomi più gravi nei topi knockout E-NTPD8 . Questi animali avevano anche un numero maggiore di cellule Th17 e neutrofili nel colon, che sono tipi di cellule immunitarie. Il trattamento di questi topi con un particolare anticorpo per eliminare i neutrofili ha notevolmente migliorato i sintomi della colite grave, mentre l’esaurimento di altri vari tipi di cellule immunitarie no.
“Ulteriori esperimenti ci hanno mostrato che un’interazione molecolare tra ATP e un recettore chiamato P2X4R è fondamentale qui“, spiega l’autore senior dello studio Hisako Kayama. “I topi privi sia di E-NTPD8 che di P2X4R hanno avuto un significativo miglioramento della malattia, nonché un numero ridotto di neutrofili rispetto ai topi normali”.
Vedi anche:Colite ulcerosa: remissione clinica con Mirikizumab di Lilly
Il team ha determinato che l’ATP luminale potrebbe promuovere un processo chiamato glicolisi attraverso P2X4R nei neutrofili, che prolunga la loro sopravvivenza. Questo alla fine porta ad un aumento dell’infiammazione causata dall’accumulo di neutrofili all’interno del colon.
“I nostri dati suggeriscono che il controllo della segnalazione luminale di ATP-P2X4R e dei livelli di espressione di E-NTPD8 potrebbe essere utilizzato per l’intervento terapeutico nella colite ulcerosa umana“, spiega Kayama.
Le malattie infiammatorie intestinali come la colite ulcerosa e il morbo di Crohn hanno un impatto negativo sulla vita di milioni di persone in tutto il mondo. I dati presentati da questo gruppo forniscono una direzione promettente per lo sviluppo di nuovi metodi terapeutici per questi disturbi.
“Questo studio identifica un meccanismo per ridurre il numero di neutrofili nel colon e prevenire la colite grave. Ci auguriamo che i risultati della nostra ricerca portino alla delucidazione dell’eziologia della colite ulcerosa e allo sviluppo di nuove terapie. Vorremmo esprimere la nostro più profondo gratitudine a tutti i colleghi e ai pazienti che hanno fornito i campioni”, ha affermato Kayama.