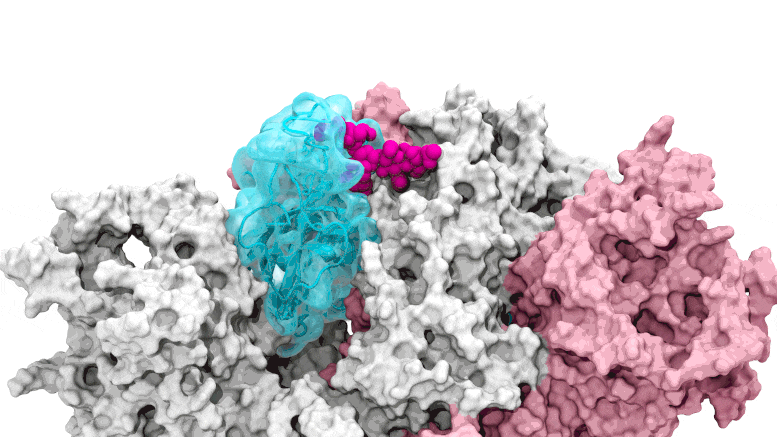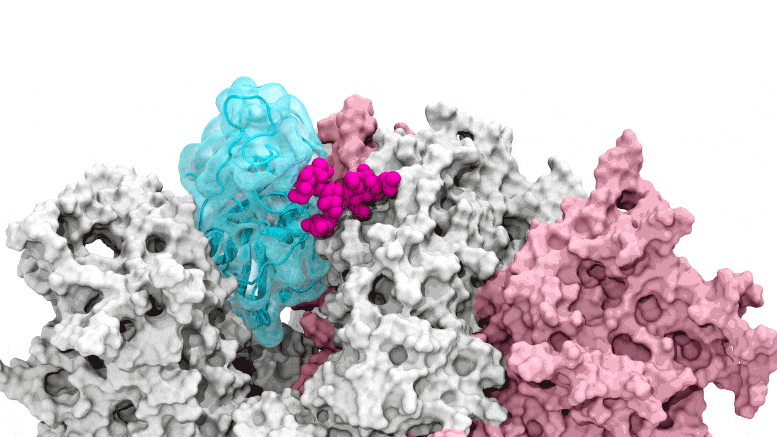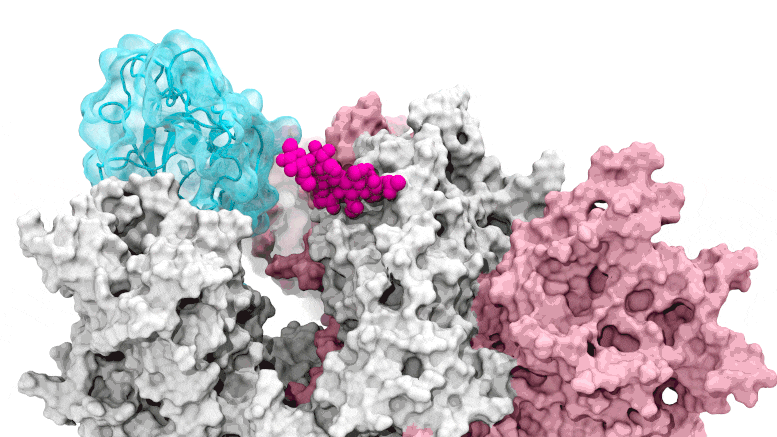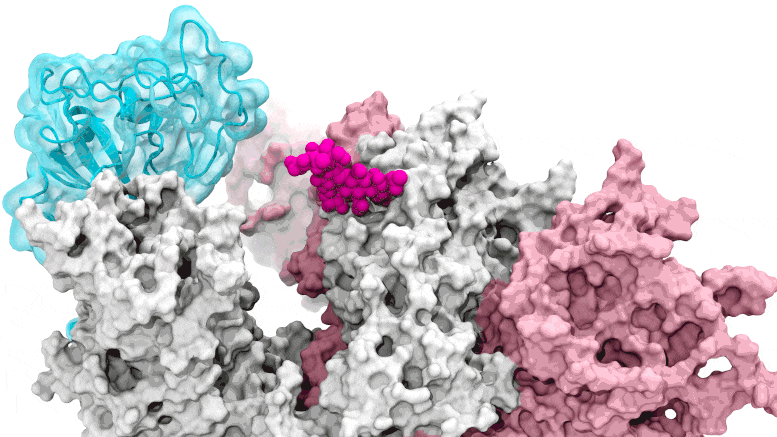
SARS-CoV-2. Il cancello del glicano si apre: le simulazioni guidate dal supercalcolo raffigurano il glicano N343 (magenta) che agisce come un piede di porco molecolare per aprire il dominio di legame del recettore del picco SARS-CoV-2, o RBD (ciano), dal “basso” verso “l’alto”. Crediti: Terra Sztain, Surl-Hee Ahn, Lorenzo Casalino (Amaro Lab, UC San Diego)
(SARS-CoV-2)- I film derivati dal supercalcolo rivelano dettagli del rivestimento ingannevole di zucchero sulla proteina spike di SARS-CoV-2, presentando nuove possibilità per bloccare l’ingresso delle cellule e l’infezione.
Fin dai primi giorni della pandemia di COVID 19, gli scienziati hanno perseguito in modo aggressivo i segreti dei meccanismi che consentono alla sindrome respiratoria acuta grave coronavirus 2 ( SARS-CoV-2 ) di entrare e infettare le cellule umane sane.
All’inizio della pandemia, Rommie Amaro dell’Università di San Diego, un chimico biofisico computazionale, ha contribuito a sviluppare una visualizzazione dettagliata della proteina spike SARS-CoV-2 che si aggancia in modo efficiente ai nostri recettori cellulari. Ora, Amaro e i suoi colleghi ricercatori dell’UC San Diego, dell’Università di Pittsburgh, dell’Università del Texas ad Austin, della Columbia University e dell’Università del Wisconsin-Milwaukee hanno scoperto come i glicani, molecole che costituiscono un residuo zuccherino attorno ai bordi della proteina spike, possono agire come gateway di infezione.
Pubblicato il 19 agosto sulla rivista Nature Chemistry, uno studio condotto da Amaro, co-autore senior Lillian Chong presso l’Università di Pittsburgh, primo autore e studente laureato dell’UC San Diego Terra Sztain e co-primo autore e studioso post-dottorato dell’UC San Diego Surl -Hee Ahn, descrive la scoperta di “porte” di glicani che si aprono per consentire l’ingresso di SARS-CoV-2 nell’ospite.
“In sostanza abbiamo capito come spike si apre e infetta”, ha detto Amaro, Professore di chimica e biochimica e autore senior del nuovo studio. “Abbiamo svelato un importante segreto della proteina spike nel modo in cui infetta le cellule.Senza questa porta il virus è sostanzialmente reso incapace di infettare”.
Vedi anche:SARS-CoV-2: quando è più trasmissibile?
Le simulazioni guidate dal supercalcolo raffigurano il glicano N343 (magenta) che agisce come un piede di porco molecolare per aprire il dominio di legame del recettore della proteina spike di SARS-CoV-2, o RBD (ciano), da una posizione “giù” a una “su”. Crediti: Terra Sztain, Surl-Hee Ahn, Lorenzo Casalino (Amaro Lab, UC San Diego).
Amaro ritiene che la scoperta di questo cancello nascosto del viryus SARS-CoV-2 da parte del team di ricerca, apra potenziali strade per nuove terapie per contrastare l’infezione da SARS-CoV-2. Se le porte del glicano potessero essere farmacologicamente bloccate in posizione chiusa, allora si impedirebbe efficacemente al virus di aprirsi all’ingresso e all’infezione.
Il rivestimento di spike di glicani aiuta a ingannare il sistema immunitario umano poiché si presenta come nient’altro che un residuo zuccherino. Le tecnologie precedenti che hanno ripreso queste strutture raffiguravano i glicani in posizioni statiche aperte o chiuse, che inizialmente non hanno suscitato molto interesse da parte degli scienziati. Le simulazioni di supercalcolo hanno quindi permesso ai ricercatori di sviluppare filmati dinamici che hanno rivelato l’attivazione dei gate glicani da una posizione all’altra, offrendo un pezzo senza precedenti della storia dell’infezione.
“Siamo stati effettivamente in grado di guardare l’apertura e la chiusura dei glicani”, ha detto Amaro. “Questa è una delle cose davvero interessanti che queste simulazioni ti danno: la possibilità di vedere film davvero dettagliati. Quando li guardi ti rendi conto che stai vedendo qualcosa che altrimenti avremmo ignorato. Guardi solo la struttura chiusa, e poi guardi la struttura aperta, e non sembra niente di speciale. È solo perché abbiamo catturato il film dell’intero processo che abbiamo vistro i glicani effettivamente fare il loro lavoro”.
“Le tecniche standard avrebbero richiesto anni per simulare questo processo di apertura, ma con gli strumenti di simulazione avanzati del mio laboratorio, siamo stati in grado di catturare il processo in soli 45 giorni”, ha affermato Chong.
Le simulazioni computazionalmente intensive sono state eseguite prima su Comet presso il San Diego Supercomputer Center presso l’UC San Diego e successivamente su Longhorn presso il Texas Advanced Computing Center di UT Austin. Tale potenza di calcolo ha fornito ai ricercatori viste a livello atomico del dominio di legame del recettore della proteina spike, o RBD, da più di 300 prospettive. Le indagini hanno rivelato che il glicano “N343” è il fulcro che fa leva sull’RBD dalla posizione “giù” a “su” per consentire l’accesso al recettore ACE2 della cellula ospite. I ricercatori descrivono l’attivazione del glicano N343 come simile a un meccanismo a “piede di porco molecolare”.
Jason McLellan, Professore associato di bioscienze molecolari presso l’UT Austin e il suo team hanno creato varianti della proteina spike e le hanno testate per vedere come la mancanza del gate glicano influisse sulla capacità dell’RBD di aprirsi.
“Abbiamo dimostrato che senza questo cancello di glicani, l’RBD della proteina spike non può assumere la conformazione di cui ha bisogno per infettare le cellule”, ha detto McLellan.
Fonte:Nature