(SARS-CoV-2-Immagine Credit Public Domain).
Ricercatori negli Stati Uniti hanno dimostrato che la proteina spike virale utilizzata da SARS-CoV-2 per infettare le cellule ospiti adotta una conformazione aperta che espone nuovi epitopi che potrebbero fungere da bersagli per strategie terapeutiche per la protezione contro COVID-19.
I vaccini COVID-19 attualmente approvati e molte tecniche diagnostiche cliniche si basano sull’ectodominio dello spike SARS-CoV-2 che stabilizza la proteina nella conformazione della prefusione.
Ora, un team dell’Università della California a Berkeley, dell’Università del Texas ad Austin e di Chan Zuckerberg Biohub a San Francisco hanno identificato una nuova conformazione che espone l’interfaccia del trimero conservata che altrimenti sarebbe sepolta nello stato di prefusione. “Successivamente, questo espone potenziali epitopi per il riconoscimento di anticorpi e ligandi pan-coronavirus”, affermano Susan Marqusee e colleghi. “La conoscenza della struttura e delle popolazioni di questa conformazione aiuterà a migliorare la diagnostica, le terapie e i vaccini esistenti”, scrivono.
Una versione prestampata del documento di ricerca è disponibile sul server bioRxiv *, mentre l’articolo è sottoposto a peer review.
Maggiori informazioni sulla proteina spike virale di SARS-CoV-2
La proteina Spike di SARS-CoV-2 è una grande proteina trimerica che media la fase iniziale del processo di infezione quando il suo dominio legante il recettore (RBD) si attacca all’enzima di conversione dell’angiotensina 2 (ACE2) del recettore della cellula ospite. Poco dopo il rilascio della sequenza del genoma SARS-CoV-2 nel gennaio 2020, è stata sviluppata una versione dell’ectodominio spike – S-2P – che stabilizza la conformazione della prefusione.
Questo ectodominio S-2P è stato ampiamente utilizzato per lo sviluppo di vaccini e in molti studi sulla struttura e la funzione dell’ectodominio a picco. Più di 250 strutture di ectodomini spike SARS-CoV2 sono ora disponibili nella banca dati proteica. “Questi studi strutturali insieme ad altri studi funzionali dimostrano che, come tutte le proteine di fusione virale di classe 1, la proteina spike è dinamica, campionando diverse conformazioni durante il suo ciclo di vita funzionale“, afferma Marqusee e colleghi.
Tre singoli RBD adottano una conformazione “su” e una “giù”, con la conformazione su che espone il motivo di legame ACE2 necessario per l’infettività. Dopo il legame e la scissione del recettore tra le subunità S1 e S2, la spike subisce un evento di ripiegamento per consentire la fusione, prima di adottare una conformazione post-fusione stabile. Tuttavia, Marqusee e colleghi affermano che ci sono pochissimi studi sperimentali che forniscono informazioni sulla dinamica dello stato di prefusione. “Sperimentalmente, il panorama conformazionale della spike non è stato ben interrogato e gli effetti delle perturbazioni, come il legame con il ligando (sia recettori che anticorpi) o le sostituzioni di amminoacidi trovate nelle varianti emergenti di preoccupazione sono sconosciuti”, scrive il team.
Cosa hanno fatto i ricercatori?
I ricercatori hanno utilizzato lo scambio di idrogeno deuterio monitorato dalla spettrometria di massa (HDX-MS) per studiare il panorama dell’ectodominio della prefusione degli spike e gli effetti del legame del ligando e della variazione di sequenza. “HDX-MS offre un complemento ideale al numero sempre crescente di studi strutturali sulla proteina spike SARS-CoV-2, fornendo informazioni sul suo insieme conformazionale e sulle dinamiche”, afferma il team. I risultati hanno indicato che la proteina spike popola due conformazioni all’interno dello stato di prefusione: la struttura di prefusione canonica (stato A) e un’altra conformazione inaspettata con un’interfaccia trimero aperta più esposta (stato B).
Quando i ricercatori hanno usato la temperatura per perturbare la struttura, è stato scoperto che le due conformazioni si interconvertono in modo reversibile, con una preferenza per lo stato B a 4 °C e per lo stato A a 37 °C.
La nuova conformazione di SARS-CoV-2 è un trimero aperto
Lo stato B espone l’interfaccia del trimero S2 conservata che è altrimenti sepolta nella conformazione della prefusione, fornendo così nuovi potenziali epitopi per il riconoscimento di anticorpi e ligandi pan-coronavirus.
Per verificare se le mutazioni possono influenzare l’interconversione della conformazione A e B, il team ha monitorato la conversione per una variante di HexaPro che include cinque mutazioni trovate in S1 della variante B.1.1.7 (alfa) emersa nel Regno Unito.
Vedi anche:Variante Delta SARS-CoV-2: perchè è così preoccupante?
Infatti, l’HexaPro S1 del Regno Unito ha mostrato differenze sia nella preferenza relativa per lo stato B che nella cinetica dell’interconversione.
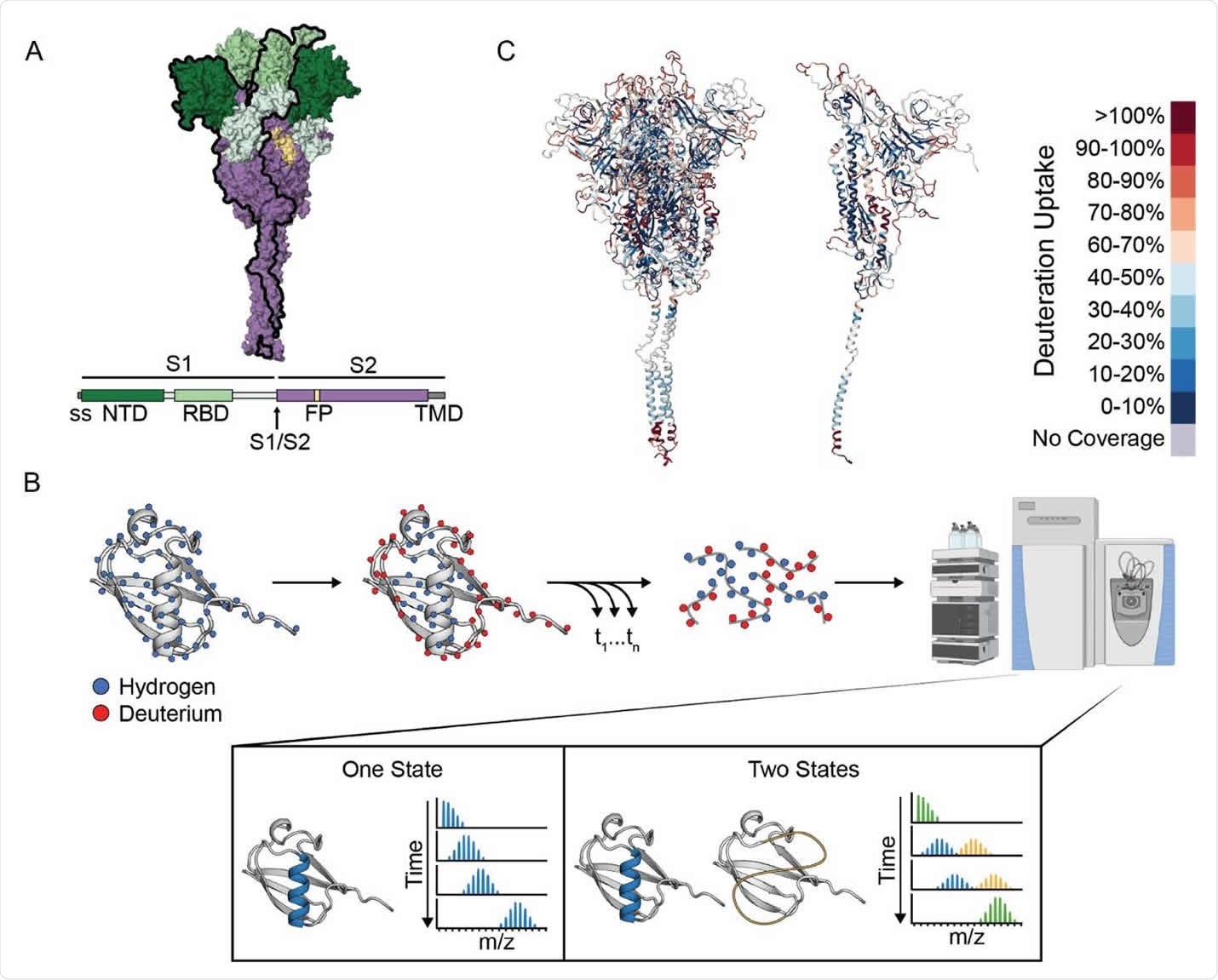
A 4 °C, l’HexaPro S1 del Regno Unito si è convertito allo stato B quasi 20 volte più rapidamente dell’HexaPro originale. “Quindi, nonostante la loro posizione nella subunità S1 e non nell’interfaccia del trimero centrale, queste specifiche mutazioni B.1.1.7 influenzano allostericamente l’interconversione di questi due stati”, scrivono i ricercatori.
Testare gli effetti di un anticorpo sviluppato di recente
Un anticorpo sviluppato di recente chiamato 3A3 che si lega sia a SARS-CoV-1 che a SARS-CoV-2 prende di mira un epitopo presente in una regione del picco (intorno ai residui da 980 a 1000) per il quale Marqusee e colleghi avevano precedentemente osservato un comportamento bimodale.
Tuttavia, questa regione era stata considerata inaccessibile poiché è sepolta nella struttura di prefusione quando tutti i RBD sono bassi ed è anche occlusa quando i RBD sono alti.
È interessante notare che i dati HDX hanno indicato che questa regione è esposta dopo la conversione allo stato B.
Quando il team ha ripetuto l’esperimento HDX in presenza di 3A3, è stato osservato un livello di protezione significativamente aumentato nella regione 978-1001 che era direttamente associata allo stato B.
Cosa hanno concluso gli autori?
I ricercatori affermano che un’ulteriore comprensione di questo stato B appena identificato contribuirà a migliorare lo sviluppo di diagnostica, terapie e vaccini. “I dati suggeriscono collettivamente che lo stato B espone epitopi ampiamente sensibili alla neutralizzazione che potrebbero essere di interesse per future terapie e vaccini”, affermano Marqusee e colleghi.
Inoltre, questi epitopi si trovano nella parte più altamente conservata della proteina spike – l’interfaccia del trimero S2 – e quindi rappresentano un bersaglio ideale per i vaccini che fornirebbero protezione attraverso diversi coronavirus.
*Avviso IMPORTANTE
bioRxiv pubblica rapporti scientifici preliminari che non sono sottoposti a revisione paritaria e, pertanto, non devono essere considerati conclusivi.
Fonte:bioRxiv