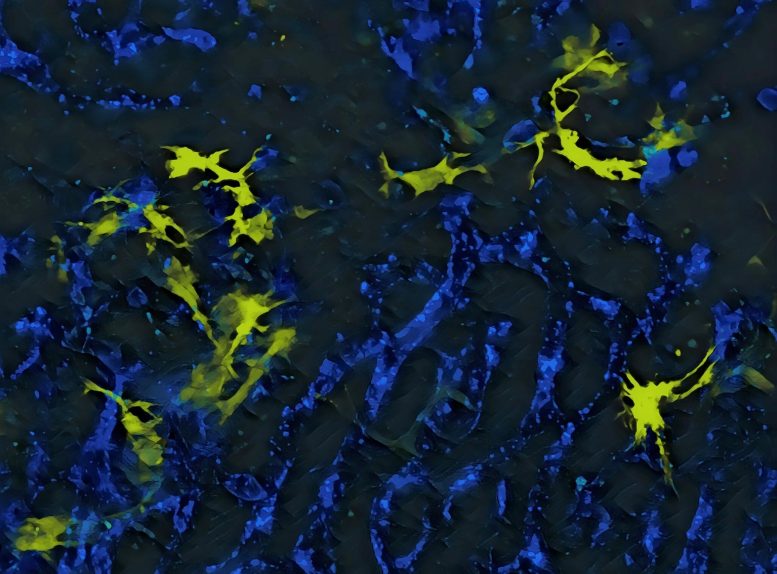
(Cancro-Immagine: in giallo: macrofagi epatici o cellule di Kupffer che secernono la proteina IL-12 che causa gli effetti negativi dell’immunoterapia. In blu, vasi sanguigni. Credito: © UNIGE – Mikaël Pittet).
Identificando il meccanismo di tossicità indotto dalle immunoterapie, gli scienziati dell’UNIGE e della Harvard Medical School stanno aprendo la strada a trattamenti contro il cancro con minori effetti collaterali.
Negli ultimi anni, l’immunoterapia ha rivoluzionato il campo della cura del cancro. Tuttavia, le reazioni infiammatorie nei tessuti sani provocano frequentemente effetti collaterali che possono essere gravi e portare all’interruzione permanente del trattamento. Questa tossicità è ancora poco conosciuta ed è uno dei principali ostacoli all’uso dell’immunoterapia. Scienziati dell’Università di Ginevra (UNIGE), Svizzera, e della Harvard Medical School, Stati Uniti, sono riusciti a stabilire le differenze tra le reazioni immunitarie deleterie e quelle mirate alle cellule tumorali. Sembra che mentre i meccanismi immunitari sono simili, le popolazioni cellulari coinvolte sono diverse.
Questo lavoro, pubblicato sulla rivista Science Immunology, consente di prevedere trattamenti mirati, più efficaci e meno pericolosi per i malati di cancro. Basate su una massiccia stimolazione del sistema immunitario del paziente, le immunoterapie hanno salvato molte vite. Purtroppo non sono senza conseguenze. “Quando il sistema immunitario viene attivato così intensamente, la reazione infiammatoria risultante può avere effetti dannosi e talvolta causare danni significativi ai tessuti sani”, afferma Mikaël Pittet, titolare della cattedra della Fondazione ISREC in Onco-Immunologia presso la Facoltà di Medicina dell’UNIGE Dipartimento di Patologia e Immunology and Center for Translational Research in Onco-Haematology, e membro del Swiss Cancer Center Leman. “Pertanto, volevamo sapere se ci sono differenze tra una risposta immunitaria desiderata, che mira a eliminare il cancro e una risposta indesiderata, che può influenzare i tessuti sani. L’identificazione di elementi distintivi tra queste due reazioni immunitarie consentirebbe infatti lo sviluppo di nuovi approcci terapeutici, più efficaci e meno tossici”.
Utilizzando campioni di biopsia epatica di pazienti che avevano subito tali reazioni tossiche, gli scienziati hanno studiato i meccanismi cellulari e molecolari al lavoro per rivelare somiglianze e dissomiglianze.
Vedi anche:Biomolecole di grasso associate a vari tipi di cancro
Una risposta simile, ma con cellule diverse
In una risposta tossica correlata all’immunoterapia, due tipi di cellule immunitarie – macrofagi e popolazioni di neutrofili – sembrano essere responsabili dell’attacco ai tessuti sani, ma non sono coinvolti nell’uccisione delle cellule tumorali. Al contrario, un altro tipo di cellula, una popolazione di cellule dendritiche, non è coinvolto nell’attacco ai tessuti sani, ma è essenziale per eliminare le cellule tumorali.
“Le immunoterapie possono innescare la produzione di proteine specializzate che allertano il sistema immunitario e innescano una risposta infiammatoria”, spiega Mikaël Pittet. “In un tumore, queste proteine sono benvenute perché consentono al sistema immunitario di distruggere le cellule cancerose. Nei tessuti sani, invece, la presenza di queste stesse proteine può portare alla distruzione delle cellule sane. Il fatto che queste proteine infiammatorie siano prodotte da cellule così diverse nei tumori e nei tessuti sani è quindi una scoperta interessante”.
Le cellule dendritiche sono molto rare, mentre i macrofagi e i neutrofili sono molto più comuni. Alcuni macrofagi sono presenti nella maggior parte dei nostri organi fin dalle fasi di sviluppo embrionale e vi rimangono per tutta la vita. Contrariamente a quanto si pensava in precedenza, questi macrofagi non inibiscono necessariamente l’infiammazione ma, stimolati dalle immunoterapie, possono innescare una risposta infiammatoria dannosa nel tessuto sano in cui risiedono, spiegando così perché la tossicità può colpire diversi organi.
Neutralizzare i neutrofili per un doppio vantaggio
Quando i macrofagi vengono attivati dai farmaci, producono proteine infiammatorie. Queste a loro volta attivano i neutrofili, che eseguono la reazione tossica. “Questo apre la possibilità di limitare gli effetti collaterali dell’immunoterapia manipolando i neutrofili”, afferma Mikaël Pittet.
Il team di ricerca ha confermato la scoperta studiando le reazioni immunitarie dei topi la cui attività cellulare è stata modulata con strumenti genetici. I ricercatori sono stati in grado di identificare una scappatoia che potrebbe essere sfruttata per eliminare questi effetti collaterali. Infatti, i neutrofili producono alcuni fattori importanti per lo sviluppo della tossicità, tra cui TNF-α, che potrebbe essere un bersaglio terapeutico. Gli inibitori di TNF-α sono già utilizzati per modulare la risposta immunitaria nelle persone con artrite e potrebbero forse essere utili nel contesto del cancro per inibire gli effetti tossici dei neutrofili durante l’immunoterapia.
“Inoltre, l’inibizione dei neutrofili potrebbe essere un modo più efficace per combattere il cancro: oltre a innescare una risposta tossica, alcune di queste cellule promuovono anche la crescita del tumore. Quindi, riuscendo a controllarli, potremmo avere un doppio effetto benefico: superare la tossicità nei tessuti sani e limitare la crescita delle cellule cancerose», conclude Mikaël Pittet.
Fonte:Scitechdaily