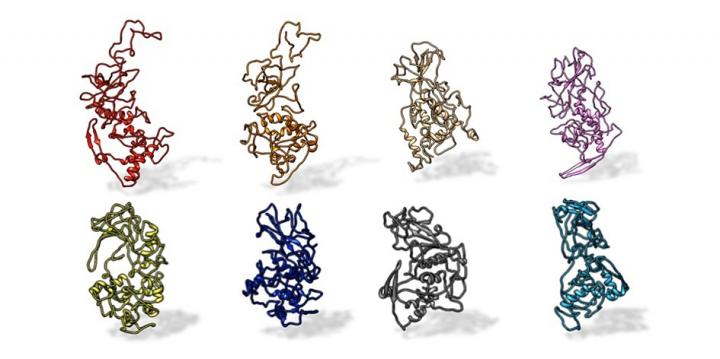
(COVID 19-Immagine: un team di ricerca della Penn State ha scoperto che la proteina N di SARS-CoV-2 è conservata in tutti i coronavirus pandemici correlati alla SARS (in alto, da sinistra: SARS-CoV-2, civet, SARS-CoV, MERS). La proteina è diversa da altri coronavirus, come quelli che causano il comune raffreddore (in basso, da sinistra: OC43, HKU1, NL63 e 229E). Credito Kelly Lab / Penn State).
Una minuscola proteina di SARS-CoV-2, il coronavirus che dà origine a COVID 19, potrebbe avere grandi implicazioni per i trattamenti futuri, secondo un team di ricercatori della Penn State.
Utilizzando un nuovo toolkit di approcci, gli scienziati hanno rivelato la prima struttura completa della proteina Nucleocapsid (N) e hanno scoperto come gli anticorpi dei pazienti COVID-19 interagiscono con quella proteina. Hanno anche determinato che la struttura appare simile in molti coronavirus, comprese le recenti varianti COVID-19, rendendola un bersaglio ideale per trattamenti e vaccini avanzati.
I ricercatori hanno riportato i loro risultati in Nanoscale.
“Abbiamo scoperto nuove funzionalità sulla struttura della proteina N che potrebbero avere grandi implicazioni nel test degli anticorpi e negli effetti a lungo termine di tutti i virus pandemici correlati a SARS”, ha affermato Deb Kelly, Professore di ingegneria biomedica (BME), Huck Chair in Molecular Biophysics e Direttore del Penn State Center for Structural Oncology, che ha guidato la ricerca. “Dal momento che sembra che la proteina N sia conservata nelle varianti di SARS-CoV-2 e SARS-CoV-1, le terapie progettate per colpire la proteina N potrebbero potenzialmente aiutare a eliminare i sintomi più duri o duraturi che alcune persone sperimentano“.
La maggior parte dei test diagnostici e dei vaccini disponibili per COVID-19 sono stati progettati sulla base di una proteina SARS-CoV-2 più grande, la proteina Spike, con cui il virus si lega alle cellule sane per iniziare il processo di invasione.
I vaccini Pfizer / BioNTech e Moderna sono stati progettati per aiutare i destinatari a produrre anticorpi che proteggono dalla proteina Spike. “Tuttavia”, ha detto Kelly, “la proteina Spike può facilmente mutare, dando origine alle varianti emerse nel Regno Unito, in Sud Africa, in Brasile e negli Stati Uniti”.
A differenza della proteina Spike esterna, la proteina N è racchiusa nel virus, protetta dalle pressioni ambientali che causano il cambiamento della proteina Spike. Nel sangue, tuttavia, la proteina N galleggia liberamente dopo essere stata rilasciata dalle cellule infette. La proteina free-roaming provoca una forte risposta immunitaria, portando alla produzione di anticorpi protettivi. La maggior parte dei kit per il test degli anticorpi cerca la proteina N per determinare se una persona è stata precedentemente infettata dal virus, al contrario dei test diagnostici che cercano la proteina Spike per determinare se una persona è attualmente infetta.
Vedi anche:COVID 19: cosa influisce sulla gravità degli esiti
“Tutti stanno guardando la proteina Spike e ci sono meno studi in corso sulla proteina N”, ha detto Michael Casasanta, primo autore dell’articolo e borsista post-dottorato nel laboratorio Kelly. “C’era questa lacuna. Abbiamo visto un’opportunità – avevamo le idee e le risorse per vedere come appare la proteina N”.
“Inizialmente, i ricercatori hanno esaminato le sequenze di proteine N degli esseri umani, nonché di diversi animali ritenuti potenziali fonti della pandemia, come pipistrelli, zibetti e pangolini. Sembravano tutti simili, ma nettamente diversi”, secondo Casasanta. “Le sequenze possono prevedere la struttura di ciascuna di queste proteine N, ma non è possibile ottenere tutte le informazioni da una previsione – è necessario vedere la struttura 3D effettiva”, ha detto Casasanta. “Abbiamo fatto convergere la tecnologia per vedere una cosa nuova in un modo nuovo”.
I ricercatori hanno utilizzato un microscopio elettronico per visualizzare sia la proteina N che il sito sulla proteina N dove si legano gli anticorpi, utilizzando il siero dei pazienti COVID-19 e hanno sviluppato un modello computerizzato 3D della struttura. Hanno scoperto che il sito di legame dell’anticorpo è rimasto lo stesso in ogni campione, rendendolo un potenziale obiettivo per il trattamento di persone con una qualsiasi delle varianti COVID-19 note.
“Se una terapia può essere progettata per indirizzare il sito di legame della proteina N, potrebbe aiutare a ridurre l’infiammazione e altre risposte immunitarie durature a COVID-19, specialmente nei trasportatori a lungo termine di COVID”, ha detto Kelly, riferendosi a persone che manifestano sintomi COVID-19 per sei settimane o più.
Il team ha procurato proteine N purificate, il che significa che i campioni contenevano solo proteine N, da RayBiotech Life e le ha applicate a microchip sviluppati in collaborazione con Protochips Inc. I microchip sono fatti di nitruro di silicio, al contrario di un carbonio poroso più tradizionale e contengono pozzetti sottili con rivestimenti speciali che attraggono le proteine N sulla loro superficie. Una volta preparati, i campioni sono stati congelati istantaneamente ed esaminati mediante microscopia crioelettronica.
Kelly ha accreditato la combinazione unica del suo team di microchip, campioni di ghiaccio più sottili e microscopi elettronici avanzati della Penn State dotati di rilevatori all’avanguardia, personalizzati dalla società Direct Electron, per fornire la visualizzazione alla più alta risoluzione di molecole a basso peso di SARS -CoV-2 finora ottenute.
“La tecnologia combinata ha portato a una scoperta unica”, ha detto Kelly. “Prima, era come cercare qualcosa di congelato nel mezzo del lago. Ora, stiamo guardando quel qualcoisa in un cubetto di ghiaccio. Possiamo vedere entità più piccole con molti più dettagli e una maggiore precisione”.
Fonte:Nanoscale