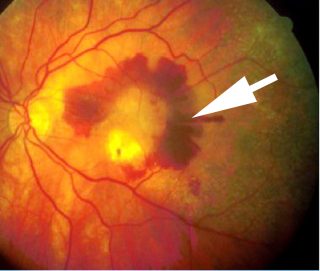
(Degenerazione maculare umida-Immagine: Credit: Public Domain).
La degenerazione maculare senile (AMD) “umida” è una delle cause più comuni di perdita irreversibile della vista negli anziani. E’ caratterizzata dalla crescita di vasi sanguigni anomali dalla coroide, in corrispondenza della macula (neovascolarizzazione coroideale). La deformazione e distorsione della visione è causata dalla fuoriuscita di sangue e fluidi dai vasi sanguigni neoformati, che si raccolgono sotto la macula e la sollevano.
Una nuova ricerca condotta da ricercatori del Massachusetts General Hospital (MGH) rivela intuizioni sui potenziali driver della malattia – che attualmente non ha cura – che potrebbero essere mirati attraverso strategie di prevenzione o trattamento.
I risultati dello studio sono stati pubblicati su eLife.
Due vie infiammatorie che coinvolgono il complemento (che è un componente del sistema immunitario) e un complesso proteico chiamato inflammasoma (che, come suggerisce il nome, innesca l’infiammazione) promuovono la formazione di vasi sanguigni anomali che sono segni distintivi della AMD umida, ma non è chiaro come vengono attivati i percorsi. Studi precedenti suggeriscono che l’inflammasoma possa essere attivato da una proteina chiamata NLRP3, principalmente nell’epitelio pigmentato retinico dell’occhio (uno strato cellulare che separa lo strato vascolare dell’occhio dalla retina).
Per indagare ulteriormente, i ricercatori hanno condotto esperimenti in un modello murino di AMD umida. Il team ha dimostrato che l’attivazione dell’inflammasoma da parte di NLRP3 si verifica principalmente nelle cellule chiamate macrofagi e microglia, ma non nell’epitelio pigmentato retinico. Gli scienziati hanno anche scoperto che proteine diverse da NLRP3 possono portare all’attivazione dell’inflammasoma e al peggioramento dell’AMD umida.
Vedi anche:Lotta alla resistenza ai farmaci nella degenerazione maculare legata all’età
“Ciò significa che invece di prendere di mira solo NLRP3 nell’AMD umida, può essere utile bloccare le proteine essenziali dell’inflammasoma che sono necessarie per la sua attivazione, indipendentemente dal fatto che NLRP3 o altre proteine inizino l’attivazione dell’inflammasoma”, spiega l’autore senior Alexander G. Marneros, MD, Ph.D., ricercatore principale presso il Cutaneous Biology Research Center di MGH e Professore associato di Dermatologia presso la Harvard Medical School. “I nostri risultati forniscono indicazioni su come bloccare gli inflammasomi nell’AMD umida”.
Marneros osserva che studi precedenti condotti su cellule suggeriscono che l’attivazione del complemento può a sua volta portare all’attivazione dell’inflammasoma, ma questo studio sui topi ha scoperto che questa attivazione si verifica in gran parte indipendentemente dall’infiammazione mediata dal complemento.
“Il nostro studio in un modello murino definisce i tipi di cellule che contribuiscono all’infiammazione mediata dall’inflammasoma nell’AMD umida e scopre i ruoli e i contributi specifici degli inflammasomi NLRP3, degli inflammasomi non NLRP3 e del complemento per la manifestazione dell’AMD umida“, afferma il ricercatore.
Oltre a fornire nuove informazioni su come l’infiammazione è regolata nell’AMD umida, lo studio suggerisce anche che nuove terapie che bloccano l’ infiammazione mediata dall’inflammasoma potrebbero essere migliorate se combinate con trattamenti che inibiscono l’ infiammazione mediata dal complemento.
“Un approccio terapeutico combinato che blocchi entrambi questi percorsi infiammatori avrà probabilmente effetti sinergici nel ridurre i sintomi della AMD umida. Pertanto, i nostri risultati in questo modello murino potrebbero avere un’importante rilevanza clinica per nuove terapie per questa comune devastante malattia”, afferma Marneros.