Immagine: Prof.Amos Tanay, Dr. Zohar Mukamel, Zohar Meir, Aviezer Lifshitz e Elad Chomsky.Credit: Weizmann.
Risulta che le cellule cancerose hanno ricordi, ma questi sono inaffidabili e possono finire per causare problemi.
Proprio come i nostri primi ricordi contribuiscono a formare le nostre personalità adulte, le cellule del nostro corpo hanno “ricordi” che modellano le loro identità. I ricordi cellulari ricordano alle nostre cellule di rimanere nel loro stato ( la pelle, le ossa), anche se queste cellule si dividono ancora e ancora. Un team di scienziati del Weizmann Institute of Science ha recentemente studiato questa memoria cellulare nelle cellule tumorali. Le loro scoperte possono aiutarci a capire meglio i tipi di “perdita di memoria” che aiutano a guidare il cancro.
Il Prof Amos Tanaydei Dipartimenti di Matematica e Informatica e Regolazione Biologica dell’Istituto spiega che come regola generale, i tumori iniziano con mutazioni genetiche, “ma queste possono spiegare solo parzialmente i cambiamenti che le cellule tumorali subiscono quando si dividono e diventano mortali”. Anche l’epigenetica – i meccanismi di memoria che danno alle nostre cellule la loro identità dicendo ad alcuni geni di essere espressi e ad altri di essere stabilmente repressi – vengono anch’essi modificati dal cancro. Questo era chiaro, ma poco altro è chiaro su se e come le cellule tumorali cambiano l’epigenetica a loro vantaggio.
Ad esempio, questa memoria viene persa o danneggiata in modo casuale nel cancro o potrebbe essere modificata più direttamente quando le cellule assumono caratteristiche più cancerose?
Anche se il processo è casuale, Tanay si è chiesto se il deterioramento dei ricordi epigenetici avrebbe comunque spinto il cancro in avanti, qualcosa nel modo in cui le mutazioni genetiche casuali alla fine cospirano per trasformare le cellule in mortali nella malattia. Tanay e il ricercatore Zohar Meir hanno deciso di scoprirlo.
Vedi anche:Il cambiamento climatico darà origine a più tumori
Per sondare la memoria delle cellule tumorali, Tanay e Meir hanno sviluppato una versione moderna di un esperimento classico ed elegante. Negli anni ’40, Salvador Luria e Max Delbrück hanno studiato una questione sulle mutazioni genetiche nei batteri. Nell’esperimento, gli scienziati hanno cercato di capire perché, quando i batteri vengono coltivati in laboratorio e sfidati con un’infezione virale, alcune cellule possono sopravvivere mentre altre muoiono.
Le cellule avevano una “memoria” dell’infezione che ha garantito resistenza alla loro progenie?
Luria e Delbruck hanno creato colonie, ciascuna da una singola cellula batterica e dopo molte generazioni hanno testato la capacità delle colonie di sopravvivere a un’infezione virale. I risultati sono stati sorprendenti: la maggior parte delle colonie non ha resistito affatto ai virus. Ma un piccolo sottoinsieme, ciascuno comprendente milioni di progenie provenienti dallo stesso batterio, era quasi completamente resistente.
Due generazioni dopo, nel loro laboratorio presso il Weizmann Institute of Science, i ricercatori hanno coltivato cellule cancerose, piuttosto che batteri. Hanno iniziato con centinaia di singole cellule tumorali e coltivato ciascuna di esse separatamente, in modo da ottenere molte colonie di cancro distinte. Per testare quanto bene questi cloni di singole cellule tumorali conservassero le loro memorie genetiche ed epigenetiche, il team ha utilizzato nuovi metodi di sequenziamento di singole cellule. Luria e Delbrück avevano verificato una sola proprietà per ciascuna delle loro colonie; al contrario, la genomica delle singole cellule del secolo ha permesso a Tanay e Meir di misurare l’RNA prodotto da migliaia di geni su migliaia di cellule contemporaneamente, determinando quali programmi di espressione genica sono silenziati e quali sono attivi in ogni cellula e in ogni colonia. Mentre le cellule tumorali sono cresciute in laboratorio per sei mesi, il team ha sequenziato il loro RNA in diversi punti lungo il percorso. Confrontando le cellule precedenti con la loro progenie, potevano dire quanto strettamente l’espressione genica rispecchiava il piano originale.
“Con nostra sorpresa”, dice Meir, “abbiamo scoperto una componente sostanziale della memoria epigenetica nelle cellule tumorali. Le cellule figlie ereditano questa memoria quasi come se fosse la loro identità genetica. In realtà dovevamo tornare attentamente alle cellule per assicurarci che non fosse la loro genetica e ciò che abbiamo scoperto era una memoria veramente non genetica mantenuta attraverso molte divisioni cellulari “.
In alcune delle cellule tumorali, prelevate dal cancro del colon-retto, i ricercatori hanno studiato più da vicino la composizione epigenetica delle cellule, osservando la metilazione del DNA, una serie di minuscoli tag chimici che si attaccano ai geni, aiutando a prevenire l’espressione genica in punti particolari del genoma. Qui, hanno scoperto che mentre le generazioni di cloni di cellule tumorali si riproducevano, alcune di quelle etichette cadevano o si muovevano e questi cambiamenti si accumulavano più rapidamente delle mutazioni nel DNA.
“La memoria epigenetica non è del tutto stabile. È qualcosa come un orologio“, dice Tanay. “Le cellule figlie possono avere solo poche nuove mutazioni, anche dopo molte generazioni, ma la metilazione in un certo senso si esaurisce lentamente, diventando sempre meno affidabile. Questa lenta deriva nella memoria epigenetica può significare la perdita di controllo, poiché anche una piccola percentuale di quei cambiamenti – rimuovere i lucchetti su alcuni geni in modo che possano essere espressi, per esempio – potrebbe aiutare ad accelerare la progressione del cancro “.
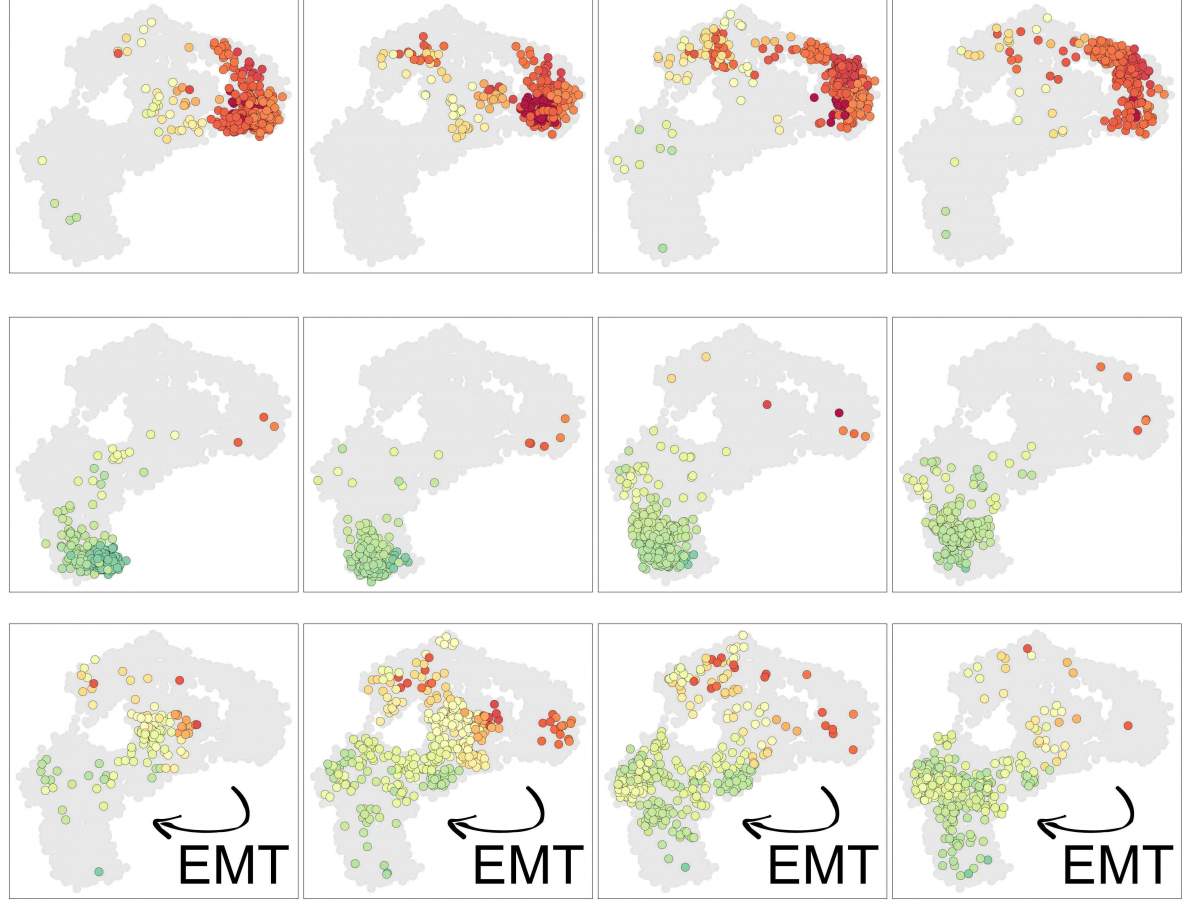
I ricercatori hanno scoperto che in alcune di queste cellule, la perdita di memoria epigenetica forse ha persino aiutato le cellule a dimenticare gradualmente quale tipo di cellula dovevano essere, consentendo loro di trasformarsi in un diverso tipo di cellula che può metastatizzare – un fenomeno noto nel cancro che non era stato completamente spiegato. “È possibile indicare salti nella progressione del cancro che sono legati alla mutazione genetica, ma nel mezzo, ci sono cambiamenti graduali nella composizione epigenetica delle cellule che possono spingerle in una direzione più cancerosa”, dice Tanay.
Gli scienziati ritengono che le loro scoperte indichino nuovi modi per comprendere meglio il funzionamento della memoria epigenetica, anche nel cancro e nelle cellule sane. Ad esempio, le loro scoperte sul ticchettio dell’orologio epigenetico hanno implicazioni non solo per il cancro, ma anche per la comprensione dei cambiamenti che avvengono in tutte le nostre cellule con l’avanzare dell’età.
Tanay e il suo team stanno già eseguendo ulteriori esperimenti utilizzando le tecniche sviluppate nel suo laboratorio per continuare a indagare su come funzionano questi ricordi nel cancro e in altre malattie.

