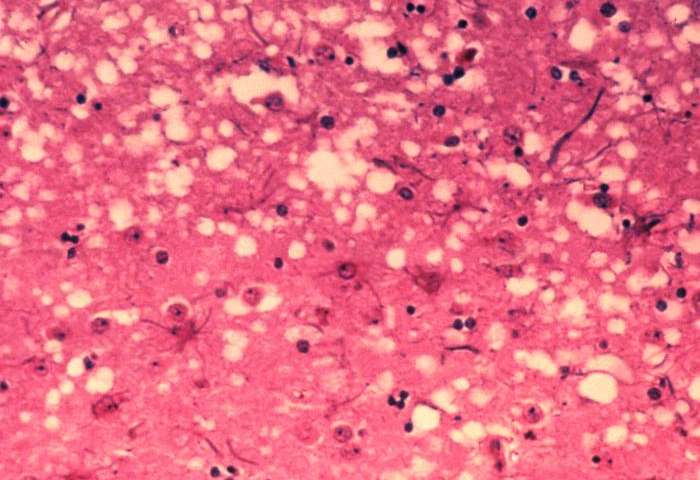
Immagine:questa micrografia del tessuto cerebrale rivela i cambiamenti istopatologici citoarchitettonici riscontrati nell’encefalopatia spongiforme bovina. La presenza di vacuoli, cioè “buchi” microscopici nella materia grigia, conferisce al cervello delle mucche colpite da BSE un aspetto spugnoso quando le sezioni di tessuto vengono esaminate in laboratorio. Crediti: Dr. Al Jenny – Public Health Image Library, APHIS: Public domain.
Le malattie prioniche sono malattie cerebrali degenerative, progressive, mortali e incurabili. Anticorpi che mirano alla versione normale della proteina prionica PrP, sono stati trovati in esseri umani selezionati a caso senza storia di encefalopatie spongiformi trasmissibili associate.
Il significato è che le proteine prioniche possono essere convertite in una particella infettiva patogena come PrPSc, una versione aggregata o isoforma resistente alla degradazione da parte degli enzimi proteasi. Le conseguenti malattie da prioni, come altre sindromi neurodegenerative come il morbo di Alzheimer e il morbo di Parkinson, sono associate all’accumulo di proteine mal ripiegate e aggregate nel sistema nervoso centrale. Gli anticorpi contro tali proteine possono essere utili e offrire un potenziale per terapie contro tali malattie prendendo di mira gli aggregati patologici per la degradazione da parte delle cellule fagocitiche.
Vedi anche:Test diagnostico rivoluzionario per le malattie da prioni
- Oggi in EMBO Molecular Medicine, ricercatori dell’Università di Zurigo e Novartis Institutes for BioMedical Research in Svizzera riferiscono di anticorpi attivi contro PrP ad alti livelli in una piccola percentuale di individui, 21 su 37.894 pazienti ospedalieri sottoposti a screening per la presenza di IgG anti-PrP, la forma più comune di immunoglobulina. C’era una forte evidenza dalla mancanza di una storia passata di malattia tra questi individui che questi anticorpi non erano neurotossici. Ciò, combinato con la mancanza di tali anticorpi tra le persone che portano mutazioni che causano malattie nel gene PRNP che codifica per le proteine prioniche, suggerisce che potrebbero aver eliminato prioni di malattie nascenti indesiderate all’inizio della vita.
Ricerche precedenti avevano già dimostrato che gli anticorpi anti-PrP sono efficaci nei topi infettati da prioni e anche in alcune cellule umane, suggerendo che potrebbero rappresentare una valida strategia terapeutica. Tuttavia, è stato anche dimostrato che l’effetto biologico degli anticorpi anti-PrP dipende in modo critico da quale parte, o epitopo, del prione PrP riconosciuto dal sistema immunitario è mirato. Pertanto, l’ultimo lavoro ha cercato di produrre una mappa ad alta risoluzione degli epitopi neuroprotettivi, con l’obiettivo finale di identificare immunoterapici che potrebbero essere efficaci, oltre che sicuri, evitando effetti neurotossici. Ciò è stato ottenuto scoprendo gli anticorpi che miravano al principale dominio globulare (GD) della proteina prionica e la sua coda flessibile (FT). Ciò ha suggerito che ci fosse una risposta anticorpale policlonale, offrendo ulteriori prove dell’esistenza di anticorpi naturali contro la proteina prionica negli esseri umani.
La risposta immunitaria risultante in grado di eliminare i prioni infettivi nascenti può quindi operare in modo analogo alla sorveglianza immunitaria per le cellule neoplastiche che causano il cancro. Per lo meno, la generazione di anticorpi contro l’intero set di epitopi PrP fornisce nuovi strumenti per lo studio del meccanismo di neurodegenerazione veicolato dai prioni.
Fonte: EMBO Molecular Medicine