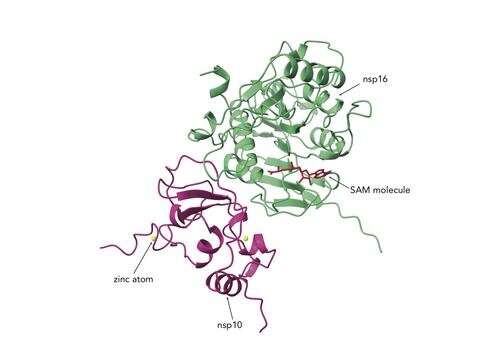
Immagine: il complesso nsp10/16. Credit: Northwestern University.
Un nuovo potenziale bersaglio farmacologico è stato identificato nel virus SARS CoV-2 – il virus che causa COVID-19 – dagli scienziati del Center of Structural Genomics of Infectious Diseases o CSGID.
Le due proteine modificano il materiale genetico del virus per renderlo più simile all’RNA umano, consentendogli di evitare le difese antivirali dell’ospite e dandogli il tempo di moltiplicarsi. I ricercatori ritengono che se si potesse sviluppare un farmaco per inibire nsp10 / nsp16, il sistema immunitario dovrebbe essere in grado di rilevare il virus e sradicarlo più rapidamente.
“Per prima cosa abbiamo progettato i costrutti – pezzi di DNA – per esprimere le due proteine”, ha detto Godzik. “Successivamente, abbiamo analizzato la struttura di queste proteine”.
La produzione delle proteine, la purificazione, la cristallizzazione e la determinazione della struttura per il test sono state eseguite presso la Northwestern University, l’Università di Chicago e l’Argonne National Laboratory. Il team sta rilasciando le strutture proteiche ad altri gruppi di scienziati che possono usarle per la ricerca di farmaci.
“Questo è un bersaglio davvero eccezionale, perché è una proteina assolutamente essenziale per la replicazione del virus“, ha dichiarato la ricercatrice Karla Satchell, Prof.ssa di immunologia e microbiologica presso la Northwestern e Direttrice CSGID.
Il team di Satchell ha inviato il complesso proteico alla Purdue University, il Centro per la scoperta di farmaci, perchè lo sottoponesse a screening per nuovi inibitori che potrebbero essere sviluppati come farmaci anti SARS-CoV-2.
Il complesso proteico nsp10 / nsp16 è chiamato RNA metiltransferasi o MTase. È composto da due proteine legate insieme. L’associazione dei due pezzi insieme è necessaria per produrre una proteina funzionale, secondo una ricerca precedente sulla SARS.
Questa è la quarta struttura proteica, potenziale bersaglio farmacologico per SARS-CoV-2, determinata dal team di scienziati CSGID.
“Abbiamo bisogno di più farmaci per curare questo virus perché è probabile che sia con noi da molto tempo”, ha detto Satchell.
Sono state inoltre determinate le strutture di altre tre proteine importanti per la replicazione del virus: endonucleasi nsp15, ribosio fosfato di ADP nsp3 e replicasi di nsp9. Queste strutture sono state determinate dagli scienziati del CSGID che lavorano all’Università di Chicago, guidati dal Professor Andrzej Joachimiak, illustre collega di Argonne e Professore presso la Northwestern. Tutto il lavoro condotto da entrambi i team dell’Università di Chicago e del Nord-Ovest è stato progettato dal team bioinformatico di Godzik, sulla base di ricerche condotte sulla SARS.
Vedi anche: COVID 19: scoperta una proteina umana che inibisce SARS-CoV-2
“Tutto questo fa parte dello sforzo per mappare l’intero repertorio strutturale proteico del nuovo virus“, ha dichiarato Godzik. “Espandere la copertura strutturale risolvendo strutture aggiuntive è la direzione di follow-up più immediata. La seconda direzione sono gli esperimenti di co-cristallizzazione con potenziali farmaci; vogliamo sapere se e come le proteine del coronavirus si legano ad essi. Ciò contribuirebbe a migliorare i farmaci rendendoli più adatti a questo particolare patogeno”.
CSGID sta correndo per rilasciare più strutture proteiche per lo sviluppo di farmaci. L’obiettivo del Centro è determinare le strutture di tutte le proteine che sono potenziali bersagli farmacologici. Il team sta inoltre collaborando per fornire le strutture delle proteine ai ricercatori impegnati nella progettazione di vaccini.
“Il Centro ha dimostrato una grande capacità di portare la biologia strutturale alla comunità scientifica a un ritmo senza precedenti“, ha affermato Satchell.
Il Centro è sempre più impegnato perché molte Università hanno ridotto le loro attività e alcuni Laboratori hanno chiuso del tutto.
“La nostra capacità di fare esperimenti si sta attenuando”, ha detto Satchell. “Tuttavia, il Centro continuerà a rilasciare nuove strutture proteiche fino al raggiungimento del nostro obiettivo”.
Fonte: Università della California