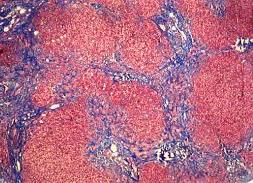
L’abuso cronico di alcol e l’epatite possono danneggiare il fegato, portando spesso ad un accumulo di collagene e tessuto cicatriziale che causano la fibrosi epatica. Comprendere questo processo potrebbe aiutare i ricercatori a sviluppare nuovi modi per prevenire o curare condizioni come epatopatia alcolica, steatoepatite non alcolica (NASH) e epatopatia non alcolica (NAFLD).
In uno studio pubblicato da Gastroenterology il 23 gennaio 2020, i ricercatori della University of California di San Diego School of Medicine hanno dimostrato per la prima volta che la progressione della fibrosi epatica potrebbe essere potenzialmente affrontata manipolando una popolazione speciale di cellule epatiche chiamate cellule stellate epatiche (HSC).
Nel fegato, le HSC si trovano in tre forme: naïve nelle persone sane, attive nelle persone con malattie epatiche e inattive nelle persone che si sono riprese dalla fibrosi epatica. Sia nel topo che nel tessuto epatico umano, i ricercatori hanno scoperto di poter controllare questo interruttore cellulare attivando o inibendo specifici fattori di trascrizione, molecole che attivano o disattivano i geni.
“Siamo entusiasti di scoprire che le HSC hanno questa flessibilità e che possiamo cambiare il loro tipo manipolando le molecole coinvolte”, ha affermato Tatiana Kisseleva, MD, Ph.D., Professore associato di chirurgia presso la UC San Diego School of Medicine. “Queste intuizioni possono permetterci di sviluppare nuovi modi per fermare la progressione della fibrosi epatica“, dice Kisseleva ha condotto lo studio con il primo autore Xiao Liu, un ricercatore nel suo laboratorio.
Vedi anche, La proteina TRAIL può uccidere le cellule che causano la fibrosi epatica e la sclerodermia
Nelle persone sane, le HSC naïve immagazzinano la vitamina A e supportano la normale funzionalità epatica: filtrano il sangue, metabolizzano i farmaci e producono acidi biliari per aiutare la digestione. Ma nelle epatopatie alcoliche o nell’epatite, le HSC si attivano e iniziano a produrre collagene, un segno distintivo della fibrosi.
“Gli obiettivi dello studio”, ha affermato Kisseleva, “erano: 1) comprendere il meccanismo che sposta le HSC dal loro stato naïve al loro stato attivo e 2) trovare modi per fermare il processo e inattivare le HSC che producono collagene”.
Kisseleva e il suo team hanno identificato diversi fattori di trascrizione che distinguono le HSC attive dalle HSC naïve che hanno studiato in campioni di fegato umano e modelli di topo. Alcuni dei fattori di trascrizione che hanno trovato impediscono l’attivazione di HSC o le inattivano. Quando i livelli di ciascuno di questi fattori di trascrizione associati alle HSC naïve erano ridotti nelle HSC del topo, le cellule si attivavano, aumentavano la loro produzione di collagene e favorivano la fibrosi. La fibrosi epatica era più grave nei topi privi di questi fattori di trascrizione.