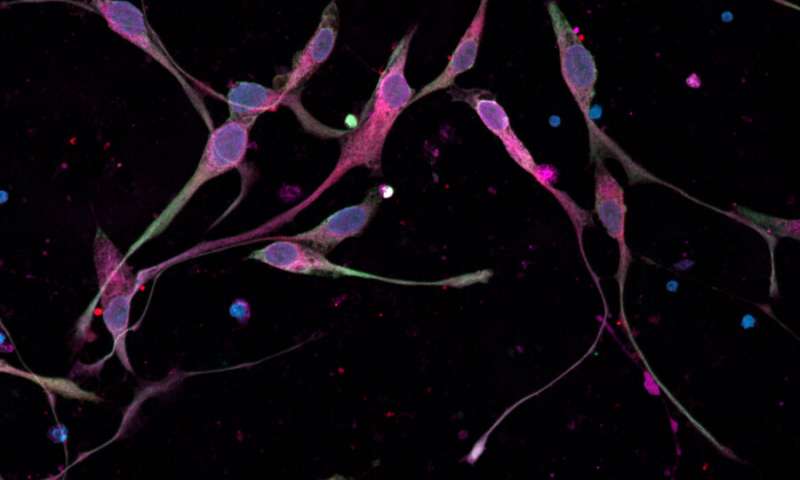
Immagine, microfotografia confocale mostra cellule DIPG, cresciute da cellule pazienti, in coltura. Le cellule esprimono diverse proteine, tra cui: DAPI (blu, nei nuclei cellulari); vimentina (rosso, un marcatore proteico di cellule staminali / precursori neurali e cellule di glioma); e Nestin (verde, anche un marcatore proteico di cellule staminali / precursori neurali e cellule di glioma). Credito: Shawn Gillespie, Monje Laboratory, Stanford Medicine.
I ricercatori hanno escogitato un nuovo piano di attacco contro un gruppo di tumori cerebrali mortali nell’infanzia chiamati collettivamente gliomi della linea mediana (DMG), tra cui glioma intrinseco pontino intrinseco (DIPG), glioma talamico e glioma del midollo spinale.
Gli scienziati del National Institutes of Health, della Stanford University, in California e del Dana-Farber Cancer Institute, Boston, hanno identificato una combinazione di farmaci che lavorano insieme sia per uccidere le cellule tumorali, sia per contrastare gli effetti di una mutazione genetica che causa le malattie.
I ricercatori hanno dimostrato che la combinazione dei due farmaci – Panobinostat e Marizomib – è risultata più efficace di entrambi i farmaci utilizzati da soli nell’uccidere cellule di pazienti con gliomi della linea mediana cresciute in laboratorio e in modelli animali.
Lo studio ha anche scoperto una vulnerabilità precedentemente non riconosciuta nelle cellule tumorali che gli scienziati potrebbero essere in grado di sfruttare per sviluppare nuove strategie contro il cancro e le malattie correlate.
I risultati sono stati pubblicati il 20 novembre su Science Translational Medicine.
Lo screening a matrice offre approfondimenti, aumenta le opzioni di trattamento
I DMG sono tumori aggressivi e difficili da trattare e rappresentano la principale causa di morte per cancro al cervello tra i bambini degli Stati Uniti. I DMG in genere colpiscono alcune centinaia di bambini all’anno tra i 4 e i 12 anni. La maggior parte dei casi di DMG sono causati da una specifica mutazione nei geni dell’istone. Gli istoni sono complessi proteici nel nucleo cellulare. Il DNA avvolge gli istoni per formare la cromatina, che impacchetta il DNA nel nucleo. Il modo in cui il DNA si snoda e si svolge intorno agli istoni è influenzato dagli enzimi, comprese le deacetilasi dell’istone. Questi enzimi aggiungono o rimuovono i tag chimici, che controllano indirettamente se i geni sono attivati o disattivati.
In uno studio precedente, la neuro-oncologa di Stanford Michelle Monje. M.D., Ph.D. e i suoi colleghi hanno dimostrato che Panobinostat, che blocca gli enzimi chiave dell’istone deacetilasi, potrebbe ripristinare la funzione dell’istone DIPG a uno stato più normale. Panobinostat è già nei primi test clinici nei pazienti con DIPG, tuttavia la sua utilità può essere limitata perché le cellule tumorali possono imparare a eludere i suoi effetti. Quindi il team di Monje ha voluto identificare altri possibili farmaci – e combinazioni di essi – che potrebbero influenzare il cancro.
“Pochissimi tumori possono essere curati da un singolo farmaco”, ha dichiarato Monje, autore senior dello studio che tratta i bambini con DIPG e altri gliomi della linea mediana diffusi. “Sappiamo da molto tempo che avremmo bisogno di più di un’opzione di trattamento per DIPG. La sfida è dare la priorità a quelle giuste quando ci sono migliaia di potenziali opzioni. Speriamo che questa combinazione aiuterà questi bambini”.
Monje e Katherine Warren, M.D. del National Cancer Institute, ora al Dana-Farber Cancer Institute e al Boston Children’s Hospital, hanno collaborato con Craig Thomas, Ph.D. e i suoi colleghi del National Center for Advancing Translational Sciences (NCATS) del NIH. Thomas e il suo team hanno utilizzato l’esperienza di screening dei farmaci NCATS e la tecnologia di screening a matrice per esaminare i farmaci e le combinazioni di farmaci per vedere quali erano tossici per le cellule dei pazienti DIPG.
Le tecnologie di screening ad alta produttività e abilitazione alla robotica di NCATS consentono agli scienziati di testare rapidamente migliaia di diversi farmaci e combinazioni di farmaci in vari modi. Gli scienziati possono esaminare i singoli farmaci e le combinazioni più promettenti, determinare le dosi più efficaci di ciascun farmaco e imparare di più sui possibili meccanismi con cui questi farmaci agiscono.
I ricercatori NCATS hanno prima studiato gli effetti dei singoli farmaci approvati e dei composti investigati sui modelli di cellule DIPG cresciuti in laboratorio dalle cellule dei pazienti. Si sono concentrati su agenti che potrebbero sia uccidere le cellule DIPG che attraversare la barriera emato-encefalica protettiva del cervello, una necessità per un farmaco per essere efficace contro DIPG nei pazienti. Il team ha quindi testato i singoli agenti più efficaci in varie combinazioni.
“Tali schermi di farmaci così grandi e complessi richiedono un enorme sforzo di collaborazione”, ha affermato Thomas, anche autore senior dello studio. “NCATS è stato progettato per riunire biologi, chimici, ingegneri, in modo da consentire questi studi tecnicamente impegnativi”.
Ci sono stati risultati multipli e promettenti da questi schermi. Il team si è concentrato sulla combinazione di inibitori dell’istone deacetilasi (come il panobinostat) con farmaci chiamati inibitori del proteasoma (come il marizomib). Gli inibitori del proteasoma bloccano i normali processi di riciclaggio delle proteine delle cellule. La combinazione panobinostat-marizomib era altamente tossica per le cellule DIPG in diversi modelli, tra cui colture di cellule tumorali DIPG che rappresentavano i principali sottotipi genetici della malattia e topi con cellule trapiantate dai tumori dei pazienti. La combinazione ha anche ridotto le dimensioni del tumore nei topi e aumentato la loro sopravvivenza. Una risposta simile è stata trovata nei modelli DMG talamo e midollo spinale sviluppati da cellule cresciute in coltura da cellule di pazienti.
Meccanismi in gioco
Gli studi di screening hanno anche fornito importanti indizi sul funzionamento dei farmaci. Basandosi su questi dati, il team collaborativo ha successivamente condotto una serie di esperimenti che hanno mostrato che le cellule DIPG hanno risposto a questi farmaci disattivando un processo biochimico nei mitocondri delle cellule che è in parte responsabile della creazione di ATP, che fornisce energia alle cellule. La combinazione di farmaci essenzialmente interrompe la produzione di ATP delle cellule tumorali.
“La combinazione di farmaci panobinostat-marizomib ha rivelato una vulnerabilità metabolica sconosciuta nelle cellule DIPG “, ha detto il primo autore dello studio Grant Lin, Ph.D., alla Stanford University School of Medicine.”
Sono in corso piani per studi clinici sulla combinazione di farmaci e sul solo Marizomib. “Molti farmaci che testiamo hanno molteplici effetti sulle cellule DIPG”, ha affermato Warren, autore senior dello studio. “Panobinostat, ad esempio, inibisce un enzima specifico, ma ha altri meccanismi che funzionano nelle cellule tumorali che possono contribuire alla sua efficacia. Stiamo ancora cercando di capire i vari talloni d’Achille in queste cellule tumorali. Questo lavoro è un passo importante per la traduzione dei nostri dati preclinici nei pazienti “.
Monje ha sottolineato che la combinazione panobinostat-marizomib potrebbe essere un componente importante di una strategia multiterapia che comprende gli approcci che sfruttano il sistema immunitario e quelli che interrompono i fattori nel microambiente tumorale da cui le cellule glioma dipendono per crescere. Come Warren, Monje ha sottolineato la necessità di comprendere meglio come i farmaci colpiscono e incidono sulle vulnerabilità delle cellule DIPG.