Immagine, nelle cellule carenti di TET, una parte delle molecole di Dnmt3a si trasferisce lontano dall’eterocromatina, spiegando la perdita apparentemente paradossale della metilazione in questa regione del genoma. Credito: Jenna Hambrick, Istituto di immunologia di La Jolla.
I ricercatori spiegano come l’equilibrio finemente sintonizzato tra metilazione e demetilazione del DNA prevenga l’instabilità genomica e il cancro
Oltre alle quattro basi principali dell’alfabeto del DNA – A, C, G e T – esiste anche una “quinta” base minore, la 5-metilcitosina (5mC), che svolge un ruolo sproporzionatamente importante nel decidere se i geni e altri elementi del DNA sono attivati o disattivati.
Non sorprende che i difetti nella metilazione della citosina siano associati ad anomalie dello sviluppo, malattie genetiche e cancro.
Nel loro ultimo studio, pubblicato nel numero online di questa settimana di Proceedings of National Academy of Sciences, i ricercatori dell’Istituto di immunologia di La Jolla (LJI), rivelano come l’equilibrio finemente sintonizzato tra metilazione e demetilazione del DNA prevenga l’instabilità genomica e il cancro.
Gli scienziati sapevano che gli enzimi conosciuti come DNMT erano responsabili di apporre il marchio 5mC sulle citosine, ma il modo in cui questo marchio è stato rimosso è rimasto un mistero per decenni.
In uno studio precedente, Anjana Rao, Professore LJI e autore senior dello studio attuale, insieme ad ex colleghi della Harvard University, Cambridge e del National Institutes of Health, Bethesda, Maryland, hanno dimostrato che le proteine correlate al cancro note come TET convertono 5mC in una “sesta base”, 5hmC, che successivamente ritorna a C. Poco dopo, è diventato chiaro che la perdita della funzione TET è fortemente legata a molti tipi di tumori, sia nell’uomo che nei topi.
Sebbene si prevede che DNMT e TET abbiano attività opposte – DNMT producono 5mC mentre i TET lo rimuovono – i tumori del sangue umano con mutazioni in TET2 o DNMT3A presentano caratteristiche simili, tra cui un aumento dei livelli di danno al DNA e instabilità del genoma. Inoltre, DNMT3A e TET2 sono le prime due proteine mutate nell’ematopoiesi clonale, una malattia dell’invecchiamento in cui alcuni cloni delle cellule staminali del sangue si espandono più di altri. Le persone con ematopoiesi clonale sono a rischio di aterosclerosi e di tumori progressivi.
Gli ultimi risultati del laboratorio Rao forniscono una spiegazione del motivo per cui le mutazioni in TET e DNMT hanno effetti simili nelle malattie.
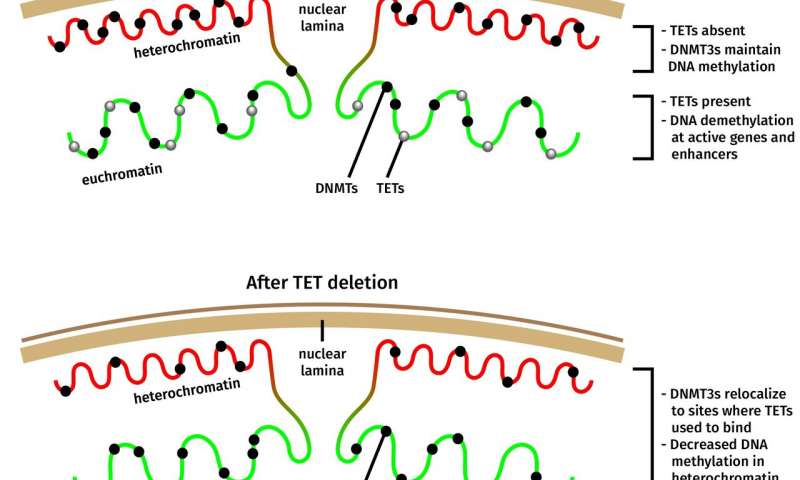
Quando Isaac F. López-Moyado, uno studente laureato nel laboratorio Rao e primo autore dello studio, ha analizzato i modelli di metilazione in un linfoma aggressivo che si è manifestato quando TET2 e TET3 sono stati eliminati nelle cellule T del topo, ha scoperto che la metilazione del DNA aumentava nelle grandi regioni del genoma come previsto. Tuttavia, questi stessi campioni di cancro possedevano regioni genomiche altrettanto grandi che avevano perso la metilazione del DNA rispetto alle normali cellule T non cancerose.
“Questo è stato sorprendente perché il dogma degli ultimi dieci anni è stato che le mutazioni TET hanno portato ad un aumento della metilazione del DNA”, ha detto López-Moyado. “Mentre questo è corretto per alcune regioni genomiche, non è vero per ampie aree del genoma note come eterocromatina”.
L’eterocromatina è una forma di DNA che è strettamente imballata, di solito inattiva e tipicamente risiede nella periferia del nucleo.
Uno sguardo più attento alla distribuzione delle molecole di Dnmt3a nelle cellule carenti di TET ha mostrato che una parte delle molecole di Dnmt3a si era trasferita nella via dall’eterocromatina, spiegando la perdita apparentemente paradossale della metilazione in questa regione del genoma.
È interessante notare che un numero considerevole di pazienti affetti da leucemia presenta sia mutazioni TET2 che DNMT3A e che topi portatori di mutazioni doppie sia in TET2 sia in DNMT3A sono noti per sviluppare tumori più gravi rispetto ai topi con sole mutazioni TET2 o DNMT3A. Questa osservazione ha spinto López-Moyado ad analizzare i dati pubblicati sulle cellule staminali ematopoietiche del topo – le cellule da cui derivano i tumori del sangue – per stabilire se le doppie mutazioni sono correlate ai cambiamenti nello stato di metilazione dell’eterocromatina.
López-Moyado ha scoperto che le cellule con doppie mutazioni TET2 e DNMT3A hanno mostrato una perdita ancora più pronunciata di metilazione del DNA nell’eterocromatina rispetto alle cellule con solo una di queste mutazioni. Infatti, anche senza mutazioni di TET o DNMT3A, la riduzione della metilazione del DNA nell’eterocromatina è comune nel cancro, suggerendo che potrebbe essere coinvolta la perdita della funzione TET o DNMT.
L’eterocromatina costituisce più della metà dei genomi dei mammiferi e contiene non solo i geni che devono essere messi a tacere in un particolare tipo di cellula, ma anche elementi “parassiti” del DNA e varie sequenze “ripetute” che hanno invaso da tempo il genoma. Questi elementi del DNA, che comprendono trasposoni e virus antichi, devono essere rigorosamente repressi nell’eterocromatina.
“Se l’eterocromatina perde la metilazione del DNA, questi elementi possono riattivarsi e possono formare strutture aberranti o saltare da una posizione genomica a un’altra, portando all’instabilità del genoma e al danno del DNA, i segni distintivi del cancro”, spiega López-Moyado. In effetti, queste caratteristiche sono comunemente osservate, insieme all’ipometilazione del DNA, in molti tipi di tumori ereditari e non ereditari, compresi i tumori con mutazioni TET e DNMT3A.
La ricerca futura stabilirà se la perdita di metilazione del DNA nell’eterocromatina che deriva da mutazioni nel percorso di metilazione del DNA ha un ruolo diretto nella riattivazione dell’eterocromatina e nell’inizio e nella progressione del cancro.