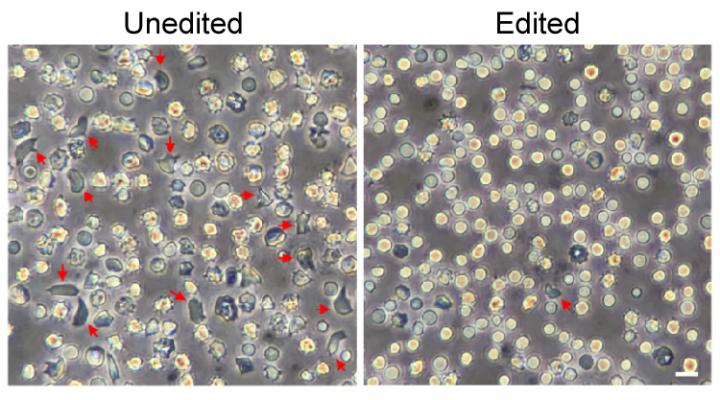
Immagine, i globuli rossi non modificati a sinistra comprendono molte cellule “falciformi” deformi, mostrate da frecce rosse. Questi sono in gran parte scomparsi nei globuli rossi prodotti da cellule staminali ematiche modificate geneticamente. Credito Daniel Bauer / Boston Children’s Hospital.
I ricercatori del Dana-Farber / Boston Children’s Cancer and Blood Disorders Center e della University of Massachusetts Medical School hanno sviluppato una strategia per trattare due delle più comuni malattie ematiche ereditarie – anemia falciforme e beta talassemia – che utilizza l’applicazione dell’editing genetico CRISPR-Cas9 alle cellule staminali del sangue dei pazienti.
Descritto questa settimana in Nature Medicine e in un articolo pubblicato a gennaio sulla rivista Blood, l’approccio supera le precedenti sfide tecniche, modificando le cellule staminali del sangue in modo più efficiente rispetto al passato.
I due studi mostrano che le cellule modificate geneticamente generano globuli rossi geneticamente corretti che producono emoglobina funzionale.
“Riteniamo che il nostro lavoro definisca una strategia che potrebbe portare alla cura dei comuni disturbi dell’emoglobina“, afferma Daniel Bauer, un medico del Dana-Farber / Boston Children’s e autore senior di entrambi gli rticolo. “La combinazione della modifica genica con un trapianto autologo di cellule staminali potrebbe essere una strategia per trattare sia l’ anemia falciforme che la beta-talassemia e altri disturbi del sangue”.
Vedi anche, Nuovo trattamento di terapia genica per l’anemia falciforme inverte i sintomi.
Insieme, l’anemia falciforme e la beta-talassemia colpiscono 332.000 nascite in tutto il mondo ogni anno, secondo l’Organizzazione Mondiale della Sanità. Entrambe le malattie coinvolgono mutazioni nel gene che codifica per la proteina beta globina.
Nella beta-talassemia, le mutazioni impediscono ai globuli rossi di produrre una quantità sufficiente della molecola di emoglobina che trasporta ossigeno, causando anemia. Nell’ anemia a cellule falciformi, la mutazione fa cambiare forma all’emoglobina, distorcendo i globuli rossi in forme “a falce” rigide che bloccano i vasi sanguigni.
Editing più efficiente
Lo studio pubblicato su Nature Medicine ha utilizzato la tecnologia CRISPR-Cas9, in particolare una proteina Cas9 modificata da un team guidato da Scot Wolfe, presso l’UMass Medical School, per ottimizzare l’editing genico. Nei precedenti tentativi di modificare i genomi delle cellule staminali del sangue umano e dei progenitori, l’efficienza, la specificità e la stabilità a lungo termine delle modifiche una volta che le cellule si sono impegnate nel midollo osseo, sono cambiate. La nuova tecnica migliora il target e la durata delle modifiche.
“La modifica efficiente della popolazione di cellule staminali del sangue – idealmente a tassi che si avvicinano al 100% – è fondamentale per ottenere un effetto terapeutico duraturo per i pazienti”, dice Wolfe, Professore nel Dipartimento di Biologia Molecolare, Cellulare e Tumorale presso UMass Medical School . “Il progresso verso questo obiettivo è derivato dai contributi di più laboratori nella comunità scientifica. Il mio team di ricerca, in collaborazione con il laboratorio Bauer, si è concentrato sul miglioramento dell’efficienza della consegna e sull’entrata nucleare della tecnologia CRISPR-Cas9 per raggiungere risultati quasi completi di modifica terapeutica dell’intera popolazione di cellule staminali del sangue“.
Il team di Bauer ha utilizzato la strategia CRISPR-Cas9 per apportare una modifica altamente mirata. Precedenti lavori al Boston Children avevano dimostrato che l’inattivazione di un gene chiamato BCL11A consente ai globuli rossi di continuare a produrre una forma fetale di emoglobina anche dopo la nascita. L’emoglobina fetale non falcizza e può sostituire l’emoglobina “adulta” difettosa. Più recentemente, Bauer ha trovato un obiettivo più sicuro: un potenziatore genetico di BCL11A che è attivo solo nei globuli rossi.
“Con il nostro nuovo protocollo molto efficiente, possiamo modificare l’enhancer BCL11A in quasi tutte le cellule staminali del sangue che raccogliamo, superando alcune delle sfide tecniche di modifica di queste cellule“, afferma Bauer.
La strategia ha consentito ai topi che trasportavano cellule staminali del sangue da pazienti affetti da anemia falciforme di produrre globuli rossi con una quantità di emoglobina fetale sufficiente per prevenire la trasformazione a falce delle cellule. Il team ha dimostrato che le cellule modificate geneticamente, reinfuse nel sangue, si sono innestate nel midollo osseo e hanno prodotto globuli rossi geneticamente corretti. Più tardi, quando le cellule staminali del sangue sono state isolate da questi topi e trapiantate in altri topi, le cellule si sono innestate di nuovo, portando ancora i cambiamenti del gene terapeutico.
Applicata alle cellule staminali del sangue di pazienti con beta-talassemia, la stessa strategia ha ripristinato il normale equilibrio delle catene globiniche che costituiscono l’emoglobina.
L’altro studio, pubblicato su Blood, ha utilizzato un protocollo di modifica genica simile per colpire forme di beta-talassemia che coinvolgono mutazioni splicing – errori in frammenti di DNA vicino al gene della beta-globina che cambiano il modo in cui il gene viene letto per assemblare beta- proteine globiniche. In questo studio, nove pazienti con beta talassemia hanno donato le loro cellule, che sono state manipolate in Laboratorio. Per alcuni pazienti, il team di UMass ha prodotto un enzima diverso, Cas12a, per indirizzare in modo più efficace le loro mutazioni. Il sistema CRISPR ha apportato modifiche in modo efficiente e ripristinato il normale splicing della proteina beta-globina nelle cellule del sangue da ciascuno dei pazienti.
Preparare il terreno per una sperimentazione clinica
I ricercatori si stanno prendendo a portare la loro strategia di modifica del potenziatore BCL11A alla clinica. Stanno sviluppando un protocollo di livello clinico, scalato per la produzione di prodotti cellulari e eseguendo studi sulla sicurezza, necessari per l’approvazione normativa da parte della FDA.
Dana-Farber / Boston Children’s ha già iniziato una sperimentazione clinica di terapia genica per l’anemia falciforme. Questo approccio aumenta la produzione di emoglobina fetale esponendo le cellule staminali del sangue dei pazienti a un lentivirus che trasporta le istruzioni per abbattere il gene BCL11A nei precursori delle cellule del sangue.
Bauer ritiene che sia importante continuare a perseguire entrambi gli approcci. “Queste condizioni sono malattie ereditarie molto comuni e si verificano soprattutto in parti del mondo in cui le risorse sono piuttosto limitate”, afferma. “Quindi abbiamo bisogno di un’ampia gamma di opzioni terapeutiche per rendere la terapia disponibile a quanti più pazienti possibile”.
Fonte, EurekAlert