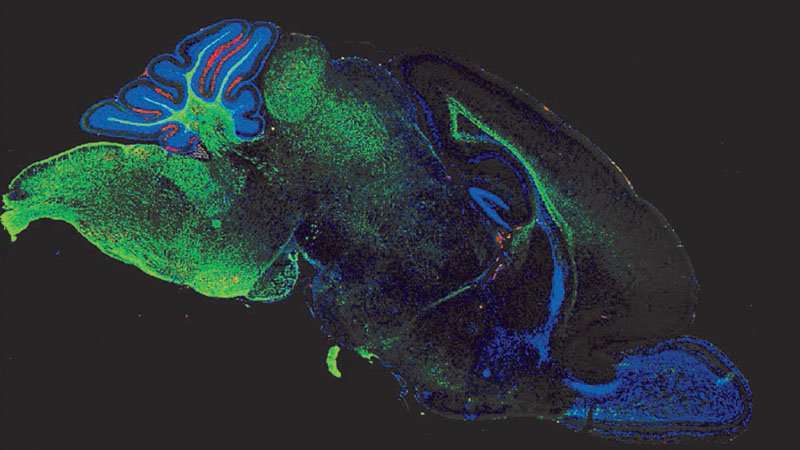
Immagine, micrografia confocale rappresentativa che mostra l’espressione della proteina basica della mielina (MBP – verde) e delle specie reattive dell’ossigeno (rosso) nel cervello (sezione mediagittale) di un topo di 11 giorni esposto a enterocolite necrotizzante sperimentale. Credito: David Hackam.
Usando un modello murino di enterocolite necrotizzante (NEC), una condizione potenzialmente fatale che causa morte improvvisa nei bambini prematuri, i ricercatori della Johns Hopkins affermano di aver scoperto le cause molecolari della condizione e delle lesioni cerebrali associate.
La scoperta ha permesso al team di combinare gli sforzi con i colleghi che studiano l’infiammazione del cervello e di identificare potenziali farmaci per invertire la lesione cerebrale nei topi.
Vedi anche Il latte artificiale può causare la morte dei bambini prematuri, attraverso la citotossicità.
I dettagli sullo studio ed i risultati appaiono in Science Translational Medicine di questa settimana.
“Fino a poco tempo fa, non c’era una chiara comprensione di ciò che causa l’enterocolite necrotizzante e l’unico approccio nei casi più gravi era rimuovere chirurgicamente l’intestino dal bambino”, dice David Hackam, Professore di chirurgia, pediatria e biologia cellulare presso la Johns Hopkins University School of Medicine. “Tuttavia, i sopravvissuti alla condizione hanno problemi diversi, tra cui un significativo deterioramento cognitivo”.
Mentre le cause esatte della NEC nei neonati non erano chiare, la malattia è nota nei neonati prematuri che soffrono di altri fattori di stress come le infezioni batteriche. Così il team ha sviluppato un modello murino di NEC separando i topi appena nati dalle loro madri e sottoponendoli a una camera a basso contenuto di ossigeno due volte al giorno per quattro giorni come fattore stressante e assicurandosi che avessero batteri intestinali simili a quelli di un bambino che aveva sviluppato severa enterocolite necrotizzante. Secondo Hackam, questi topi non solo hanno sviluppato la malattia, ma anche il loro cervello aveva mostrato la stessa lesione degli esseri umani e una compromissione della funzionalità cerebrale nei soggetti più anziani. A questo punto, i ricercatori erano pronti a capire cosa stava causando un danno cerebrale associato a NEC in questi topi.
In primo luogo, i ricercatori hanno verificato se le cellule immunitarie del cervello, la cosiddetta microglia, fossero attivate in questi topi NEC, il che significherebbe una sorta di infiammazione. Infatti, la microglia è risultata attivata. Inseguito hanno dimostrato che una proteina chiamata TLR4, che si lega ai batteri nell’intestino, è anche in grado di attivare la microglia nel cervello. Così hanno progettato topi geneticamente modificati per non contenere TLR4 sulla microglia e hanno scoperto che questi topi non sviluppavano lesioni cerebrali associate a NEC, suggerendo che TLR4 fosse la causa di tale lesione.
Il team ha quindi cercato di capire perchè questa condizione intestinale porta a lesioni cerebrali. La precedente ricerca aveva rivelato che anche la proteina TLR4 era presente nell’intestino. Secondo Hackam, TLR4 è presente nell’intestino fetale in via di sviluppo, ad alti livelli. Questi livelli diminuiscono nei neonati a termine dopo il parto. I neonati nati prematuramente, tuttavia, mantengono alti livelli di TLR4 nel loro intestino. TLR4 nell’ intestino NEC fa sì che le cellule rilasciano un’altra proteina chiamata HMGB1. Il team ha progettato i topi NEC per mancare di HMGB1. Questi topi hanno mostrato una minore attivazione microgliale nel cervello rispetto ai topi non ingegnerizzati con NEC, il che implica che, in effetti, l’HMGB1 generato da TLR4 in un intestino infiammato è la causa della lesione cerebrale associata a NEC.
Il lavoro è nato da una conversazione casuale. ” Una delle prime persone che ho incontrato quando sono arrivata qui alla Johns Hopkins nel 2014 è stata Sujatha Kannan che stava studiando lesioni cerebrali nei conigli e aveva mostrato di recente che un anti-infiammatorio applicato al cervello dei conigli poteva prevenire la paralisi cerebrale “, dice Hackam. Quindi, Hackam e Kannan si sono uniti per vedere se questo anti-infiammatorio avrebbe funzionato nei topi NEC. Hanno alimentato nanoparticelle contenenti antiossidanti e le hanno contrassegnate con una molecola fluorescente per topi con NEC e hanno esaminato il cervello dei topi per vedere dove si accumulavano le molecole incandescenti.
Abbastanza chiaro, il cervello brillava nelle stesse regioni in cui si trovano le microglia attivate. Inoltre, questi cervelli contenevano meno microglia attivata, suggerendo che i farmaci delle nanoparticelle potevano proteggere il cervello dalle lesioni cerebrali associate a NEC.
“Dovevamo cambiare il nostro modo di pensare che NEC fosse non solo una condizione dell’intestino, ma davvero anche una condizione di cervello”, dice Hackam. “Mentre questa condizione si manifesta più immediatamente nell’intestino, i neonatologi dovrebbero anche concentrarsi su una strategia protettiva del cervello che potrebbe includere un intervento chirurgico prima, riposo intestinale e antibiotici. Questa è una malattia devastante, ma ora che comprendiamo più chiaramente le sue basi molecolari”, dice Hackam, “siamo ansiosi di vedere se i risultati sono applicabili ad altri modelli e pazienti “.
Fonte, Science