I ricercatori dell’Università di Harvard hanno ideato un modello tridimensionale di un ventricolo sinistro del cuore umano che potrebbe essere utilizzato per studiare malattie, testare farmaci e sviluppare trattamenti specifici per condizioni cardiache come l’aritmia.
Il tessuto del modello è stato realizzato con uno scaffold nanofibre disseminato con cellule cardiache umane. L’impalcatura agisce come un modello 3D, guidando le cellule e il loro assemblaggio in camere ventricolari che battono in vitro. Ciò consente ai ricercatori di studiare la funzione cardiaca utilizzando molti degli stessi strumenti utilizzati nella clinica, compresi i cicli del volume della pressione e gli ultrasuoni.
La ricerca è stata pubblicata su Nature Biomedical Engineering .
“Il nostro gruppo ha trascorso oltre un decennio a lavorare all’obiettivo di costruire un cuore intero e questo è un passo importante verso questo obiettivo”, ha detto Kit Parker, il Professore di Bioingegneria e fisica applicata alla Harvard John A. Paulson School di ingegneria e scienze applicate e autore senior dello studio. “Le applicazioni, dalla medicina cardiovascolare rigenerativa al suo uso come modello in vitro per la scoperta di farmaci, sono ampie e varie”.
Parker è anche membro del Core Faculty del Wyss Institute for Biologically Inspired Engineering di Harvard, dell’Harvard Stem Cell Institute e dell’Harvard Materials Research Science and Engineering Center.
La ricerca è stata una collaborazione tra SEAS, Wyss, Boston Children’s Hospital e l’Harvard Stem Cell Institute (HSCI).
“L’obiettivo a lungo termine di questo progetto è quello di sostituire o integrare modelli animali con modelli umani e soprattutto modelli umani specifici per paziente”, ha affermato Luke MacQueen, primo autore dello studio e fellow postdoctoral presso SEAS e Wyss. “In futuro, le cellule staminali del paziente potrebbero essere raccolte e utilizzate per costruire modelli di tessuto che replicano alcune delle caratteristiche del loro intero organo”.
“Si apre una possibilità entusiasmante di realizzare modelli più fisiologici delle attuali patologie del paziente”, ha detto William Pu, Direttore della ricerca cardiovascolare di base e traslazionale all’Ospedale pediatrico di Boston, Professore di pediatria presso la Harvard Medical School, membro principale della facoltà di HSCI e co -autore dell’ articolo. “Questi modelli condividono non solo le mutazioni dei pazienti, ma tutto il background genetico del paziente”.
La chiave per costruire un ventricolo funzionale è ricreare la struttura unica del tessuto. Nei cuori nativi, le fibre miocardiche parallele fungono da impalcatura, guidando le cellule del cuore a forma di mattone per allinearle e assemblarle da un capo all’altro, formando una struttura a forma di cono vuota. Quando il cuore batte, le cellule si espandono e si contraggono come una fisarmonica.
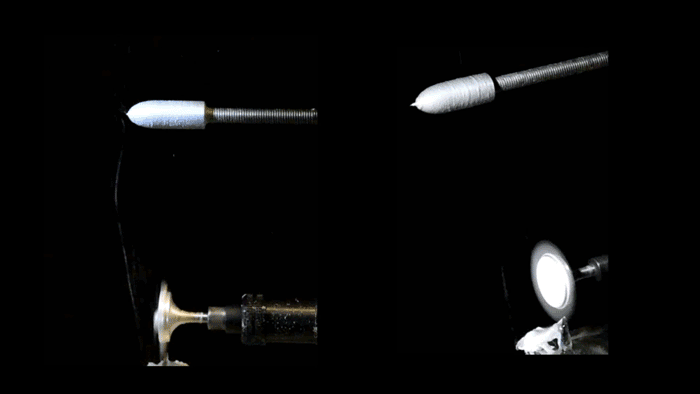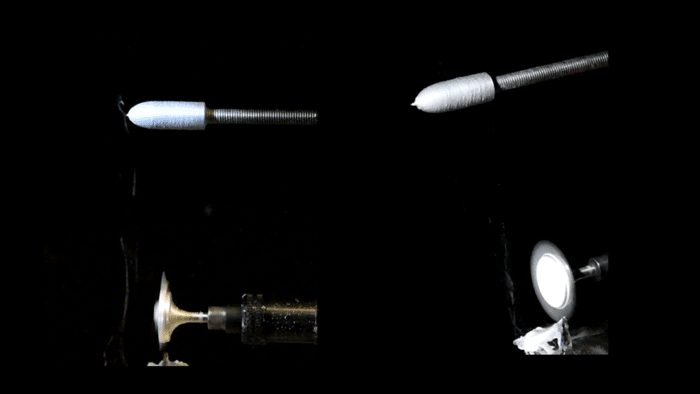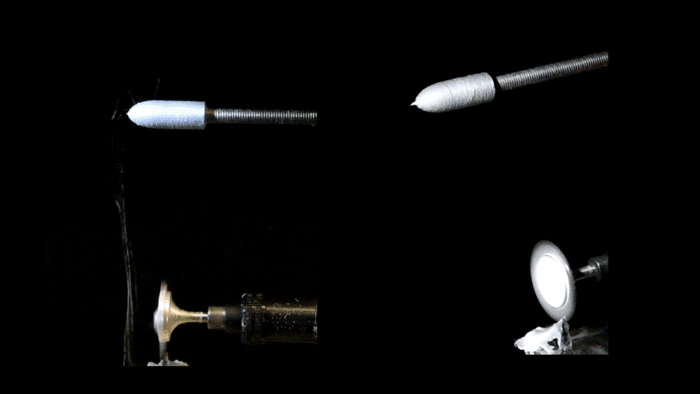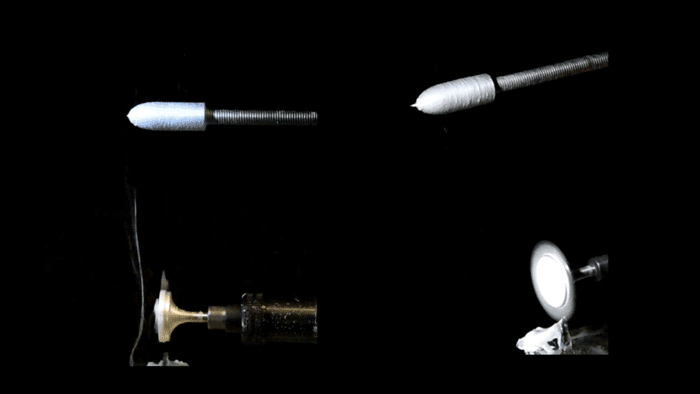
Pull-spinning di uno scaffold del ventricolo nanofibroso. Una soluzione polimerica alimentata attraverso un ago viene tirata in una fibra da una setola rotante ad alta velocità. La formazione delle fibre deriva dall’allungamento del getto e dall’evaporazione del solvente e le fibre sono raccolte su un collettore rotante del ponteggio del ventricolo ellissoidale. (Gruppo di malattie biofisiche / Harvard SEAS)
Per ricreare quell’impalcatura, i ricercatori hanno usato una piattaforma di produzione di nanofibre conosciuta come spinning, sviluppata dal Parker’s Disease Biophysics Group. La filatura a trazione utilizza una setola rotante ad alta velocità che si immerge in un serbatoio di polimero e preleva una goccia dalla soluzione in un getto. La fibra viaggia in una traiettoria a spirale e si solidifica prima di staccarsi dalle setole.
Per realizzare il ventricolo, i ricercatori hanno utilizzato una combinazione di fibre biodegradabili in poliestere e gelatina che sono state raccolte su un collettore rotante a forma di proiettile. Poiché il raccoglitore gira, tutte le fibre si allineano nella stessa direzione.
“È importante ricapitolare la struttura del muscolo naturale per ottenere i ventricoli che funzionano come le loro controparti naturali”, ha affermato MacQueen. “Quando le fibre sono allineate, le cellule saranno allineate, il che significa che condurranno e si contrarranno nel modo in cui le cellule native fanno”.
( Vedi anche:Sbloccare il potenziale di una cellula per rigenerare il cuore).
Dopo aver costruito l’impalcatura, i ricercatori hanno coltivato il ventricolo con miociti di ratto o cardiomiociti umani da cellule staminali indotte. Entro tre o cinque giorni, una sottile parete di tessuto copriva l’impalcatura e le cellule battevano in sincronia. Da lì, i ricercatori potrebbero controllare e monitorare la propagazione del calcio e inserire un catetere per studiare la pressione e il volume del ventricolo battente.
I ricercatori hanno esposto il tessuto all’isoproterenolo, un farmaco simile all’adrenalina, e misurato l’aumento della velocità di battito proprio come nei cuori umani e ratti. I ricercatori hanno anche praticato dei fori nel ventricolo per simulare un infarto del miocardio e hanno studiato l’effetto dell’attacco cardiaco in una capsula di Petri.

Questo ventricolo di ingegneria tissutale, ottenuto da tessuto miocitario ventricolare di ratto neonatale che si contrae spontaneamente, viene suturato e attaccato a un catetere. (Luke MacQueen / Disease Biophysics Group / Harvard SEAS)S)
Per studiare meglio il ventricolo per lunghi periodi di tempo, i ricercatori hanno costruito un bioreattore autonomo con camere separate per inserti di valvole opzionali, porte di accesso supplementari per cateteri e funzionalità di assistenza ventricolare opzionale.
le.

Un bioreattore autonomo con camere separate per inserti di valvole opzionali, porte di accesso supplementari per cateteri e funzionalità di assistenza ventricolare opzionale. (John Ferrier / Harvard SEAS)
Usando cardiomiociti umani da cellule staminali indotte, i ricercatori sono stati in grado di coltivare i ventricoli per 6 mesi e misurare cicli di pressione-volume stabili. “Il fatto che possiamo studiare questo ventricolo per lunghi periodi di tempo è davvero una buona notizia per studiare la progressione delle malattie nei pazienti così come le terapie farmacologiche che richiedono un po’ di tempo per agire”, ha detto MacQueen.
Successivamente, i ricercatori mirano a utilizzare cellule staminali pre-differenziate derivate dal paziente per disseminare i ventricoli, il che consentirebbe una produzione più elevata del tessuto.
“Abbiamo iniziato imparando come costruire miociti cardiaci, poi i tessuti cardiaci, poi le pompe muscolari sotto forma di mimica di organismi marini e ora un ventricolo“, ha detto Parker. “Lungo il cammino abbiamo chiarito alcune delle leggi fondamentali del design delle pompe muscolari e sviluppato idee su come fissare il cuore quando queste leggi sono infrante dalla malattia. Abbiamo una lunga strada da percorrere per costruire un cuore a quattro camere ma i nostri progressi stanno accelerando”.

