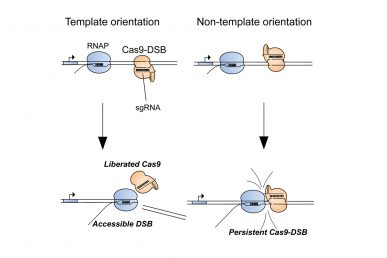
Immagine: i ricercatori dell’UIC dimostrano che il persistente legame di Cas9 a una rottura a doppio filamento fa sì che l’editing del genoma CRISPR fallisca circa il 15% delle volte. Quando le RNA polimerasi si scontrano con Cas9 da una direzione (orientamento del modello), possono rimuovere Cas9 e aumentare l’efficienza di modifica del genoma. (Foto: Ryan Clarke, et al).
I ricercatori dell’Università dell’Illinois di Chicago sono i primi a descrivere perché il metodo di modifica del gene CRISPR a volte non funziona e come il processo possa essere reso molto più efficiente.
CRISPR è uno strumento di modifica genetica che consente agli scienziati di ritagliare geni indesiderati o materiale genetico dal DNA e talvolta aggiungere una sequenza o geni desiderati. CRISPR utilizza un enzima chiamato Cas9 che agisce come una forbice per tagliare il DNA indesiderato. Una volta che i tagli vengono fatti su entrambi i lati del DNA da rimuovere, la cellula inizia la riparazione per incollare le due estremità del filamento di DNA o la cellula muore.
( Vedi anche:Per la prima volta un video cattura CRISPR/Cas9 in azione).
In uno studio pubblicato sulla rivista Molecular Cell, i ricercatori hanno dimostrato che il fallimento dell’editing genetico con CRISPR/Cas9, che si verifica in circa il 15% delle volte, è spesso dovuto al legame persistente della proteina Cas9 al DNA nel sito del taglio, che impedisce agli enzimi di riparazione del DNA, l’accesso al taglio stesso.
L’autore senior dello studio Bradley Merrill, Professore associato di biochimica e genetica molecolare all’UIC College of Medicine, afferma che prima d’ora i ricercatori non sapevano perché il processo casualmente potesse fallire.
“Abbiamo scoperto che nei siti in cui Cas9 era un ‘disastro’ rimaneva legato al filamento di DNA e impediva alla cellula di iniziare il processo di riparazione”, ha detto Merrill. Cas9 bloccato è anche in grado di continuare a fare ulteriori tagli nel DNA, limitando così l’efficienza di CRISPR.
Merrill, studente laureato all’UIC Ryan Clarke ed i suoi colleghi hanno anche scoperto che Cas9 era probabilmente inefficace nei siti del genoma in cui le RNA polimerasi – enzimi coinvolti nell’attività genica – non erano attivi. Ulteriori indagini hanno rivelato che guidare Cas9 per ricucire solo uno dei fili che compongono la doppia elica del DNA promuoveva l’interazione tra Cas9 e la RNA polimerasi, aiutando a trasformare Cas “dud” in un efficiente editor genomico.
Nello specifico, i ricercatori hanno scoperto che la selezione coerente di filamenti del DNA per Cas9 durante l’editing del genoma ha costretto le RNA polimerasi a scontrarsi con Cas9 in modo tale che Cas9 è stato eliminato dal DNA.
“Sono rimasto scioccato dal fatto che la semplice scelta di un filamento di DNA rispetto ad un altro abbia avuto un effetto così potente sull’editing del genoma”, ha affermato Clarke, autore principale dell’articolo. “Scoprire il meccanismo alla base di questo fenomeno ci aiuta a comprendere meglio come le interazioni di Cas9 con il genoma possano causare alcuni tentativi di editing e che, quando si progetta un esperimento di modifica del genoma, possiamo usare questa comprensione a nostro vantaggio”.
“Questa nuova comprensione è importante per rendere l’editing del genoma più efficiente e più sicuro negli usi clinici futuri”, ha detto Merrill.
I risultati dello studio sono significativi anche perché, nel processo di modifica del genoma, l‘interazione tra Cas9 e il filamento del DNA è ora nota come il “passo che limita la velocità”, ha detto Merrill. Ciò significa che è la parte più lenta del processo; pertanto, i cambiamenti in questa fase hanno il maggior potenziale di impatto sulla durata complessiva dell’editing del genoma.
“Se riusciamo a ridurre il tempo che Cas9 interagisce con il filamento di DNA, ora che sappiamo come fare con una RNA polimerasi, possiamo usare meno dell’enzima e limitare l’esposizione“, ha detto Merrill. “Questo significa che abbiamo più potenziale per limitare gli effetti avversi o gli effetti collaterali nelle future terapie che possono avere un impatto sui pazienti umani”.