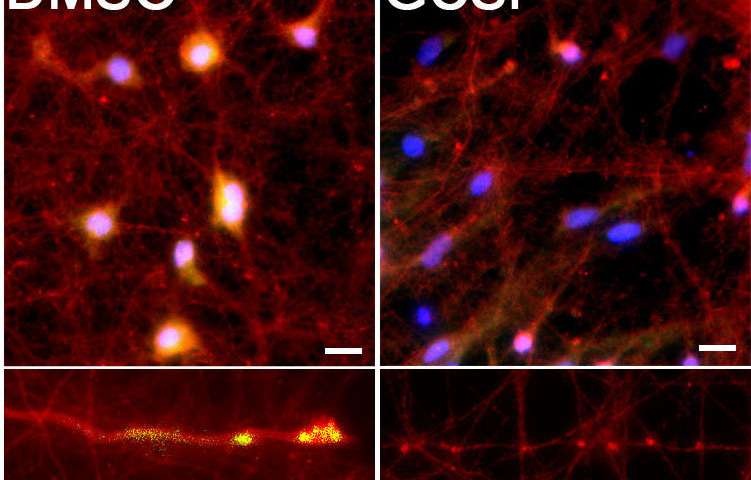
Immagine: riduzione dei lipidi utilizzando un inibitore della glucosilceramide sintasi approvato dalla FDA (GCSi) riduce l’alfa-sinucleina patologica nei corpi cellulari (in alto) e nei neuriti (in basso) dei neuroni del paziente di Parkinson. La colorazione gialla indica l’alfa-sinucleina patologica. Credito: Northwestern University.
I ricercatori della Northwestern Medicine hanno scoperto come una mutazione genetica determini l’accumulo di un composto tossico noto per causare i sintomi della malattia di Parkinson, definendo per la prima volta il meccanismo alla base di tale aspetto della malattia.
Lo studio, pubblicato su Neuron, indica un potenziale nuovo percorso terapeutico utilizzando farmaci originariamente destinati a trattare un’altra condizione, la malattia di Gaucher, secondo l’autore senior Joseph Mazzulli, assistente Professore nel Dipartimento di Neurologia Ken & Ruth Davee, Divisione dei disturbi del movimento.
Nel Parkinson, una proteina chiamata alfa-sinucleina viene convertita in cluster tossici insolubili nel sistema nervoso centrale, ma l’esatto meccanismo di conversione era sconosciuto fino ad ora.
( Vedi anche: La combinazione di due proteine esercita un effetto rigenerante nel morbo di Parkinson).
Uno dei più forti fattori di rischio per lo sviluppo di questi cluster è una mutazione nel gene GBA1, che normalmente degrada un lipide chiamato glucosilceramide. I pazienti con una mutazione nel gene soffrono di un aumento del livello di glucosilceramide e hanno un rischio aumentato di cinque volte per il morbo di Parkinson; i pazienti con due forme mutanti del gene, uno ereditato da ciascun genitore, possono sviluppare la malattia di Gaucher, un disturbo da accumulo lisosomiale .
Mazzulli ed i suoi colleghi hanno usato questa connessione genetica per chiarire il meccanismo della malattia di Parkinson influenzata da GBA1. Usando modelli di cellule staminali di neuroni, i ricercatori hanno usato un inibitore farmacologico per aumentare i livelli di glucosilceramide senza il gene mutato GBA1. Anche senza la mutazione, questo ha comportato un accumulo drammatico di alfa-sinucleina tossica nei neuroni.
“Questo ci ha suggerito che il fattore critico nel convertire l’alfa-sinucleina dalla sua forma normale alla sua forma patogenica non era necessariamente la presenza della proteina mutata GBA1, ma soprattutto la diminuzione dell’attività e dell’accumulo di glucosilceramide“, ha spiegato Mazzulli.
Con questa consapevolezza in mente, i ricercatori hanno osservato più da vicino il processo di conversione, trovando la forma sana di alfa-sinucleina realmente esistente in due diverse forme, una molecola semplice e una molecola più complessa. Mentre in precedenza si riteneva che solo la molecola semplice fosse stata convertita nella varietà tossica, Mazzulli ed i suoi colleghi hanno scoperto inaspettatamente che la molecola complessa era stata convertita direttamente dalla glucosilceramide in alfa-sinucleina tossica.
“Siamo stati sorpresi di scoprire che l’aggregazione tossica si è verificata con la conversione diretta del grande complesso alfa-sinucleina”, ha detto Mazzulli.
“Queste scoperte suggeriscono che le future terapie mirate a questa via potrebbero utilizzare farmaci originariamente concepiti per il trattamento della malattia di Gaucher”, ha aggiunto Mazzulli. Mentre l’industria farmaceutica si è interessata per un po’ di tempo all’utilizzo di questi agenti riducenti i lipidi, questo studio definisce il processo molecolare alla base di tali sforzi e dimostra come potrebbero funzionare.
“Alcune aziende hanno utilizzato inibitori della sintasi per ridurre la sintesi del lipide e nel nostro studio abbiamo utilizzato un composto simile sui neuroni derivati dal paziente”, ha dichiarato Mazzulli. “Siamo stati in grado di mostrare una ridotta aggregazione di alfa-sinucleina tossica direttamente all’interno di neuroni derivati dai pazienti di Parkinson”.
“Il nostro obiettivo finale è ridurre i livelli di alfa-sinucleina nei pazienti, tuttavia misurare i livelli di alfa-sinucleina dal sistema nervoso centrale di un paziente vivente è complicato”, ha affermato Mazzulli. “È molto più facile misurare gli effetti delle terapie che alterano la glucosilceramide nei pazienti, dal momento che il lipide può essere misurato direttamente da fluidi facilmente accessibili, come il sangue o il liquido spinale cerebrale”.
Il prossimo passo verso un trattamento funzionale sarà quello di passare da neuroni derivati da cellule staminali a modelli animali.
Ha detto Mazzulli: “Se siamo in grado di intervenire prima che si sviluppi una proteina amiloide insolubile, forse possiamo invertirla al suo stato normale”.
Fonte: Northwestern Medicine