Scoperto il meccanismo di un preciso target della risposta immunitaria.
Il sistema immunitario controlla la salute delle cellule esaminando una specie di passaporto molecolare. A volte le cellule presentano il passaporto sbagliato e questo può portare a malattie autoimmuni, infiammazioni croniche o cancro. Gli scienziati dell’Università Goethe di Francoforte spiegano come questo accade nel nuovo numero della rivista Science .
La maggior parte delle cellule fornisce alle cellule T del sistema immunitario adattativo, le informazioni sulla loro condizione, presentando componenti selezionati del loro interno (chiamati antigeni) sulla loro superficie. Se questi componenti includono frammenti di virus o componenti alterati di cellule, la cellula interessata viene eliminata. La selezione degli antigeni è essenziale in questo processo. La presenza di antigeni sbagliati conduce alle cellule sane che vengono attaccate dal sistema immunitario, causando malattie autoimmuni o infiammazioni croniche, oppure non vengono riconosciute cellule malate, consentendo alle cellule tumorali o alle cellule infette da virus di sfuggire alla sorveglianza immunitaria.
( Vedi anche:Individuato nuovo target metabolico per il controllo del sistema immunitario).
Il Dott. Christoph Thomas e il Prof. Robert Tampé dell’Istituto di Biochimica dell’Università Goethe hanno ora spiegato come a livello molecolare vengono selezionati gli antigeni che la cellula presenta sulla sua superficie cellulare. Lo studio strutturale mostra per la prima volta che tipo di controllo di qualità l’antigene subisce per consentire una risposta immunitaria precisa ed efficace .
“Il nostro lavoro risolve un problema di immunità cellulare che dura da circa 30 anni, in particolare abbiamo indagato su come vengono selezionati gli antigeni associati a tumori o agenti patogeni attraverso processi di editing e controllo di qualità per generare una risposta immunitaria specifica “, spiega Prof. Robert Tampé nella significativa pubblicazione.
Abstract:
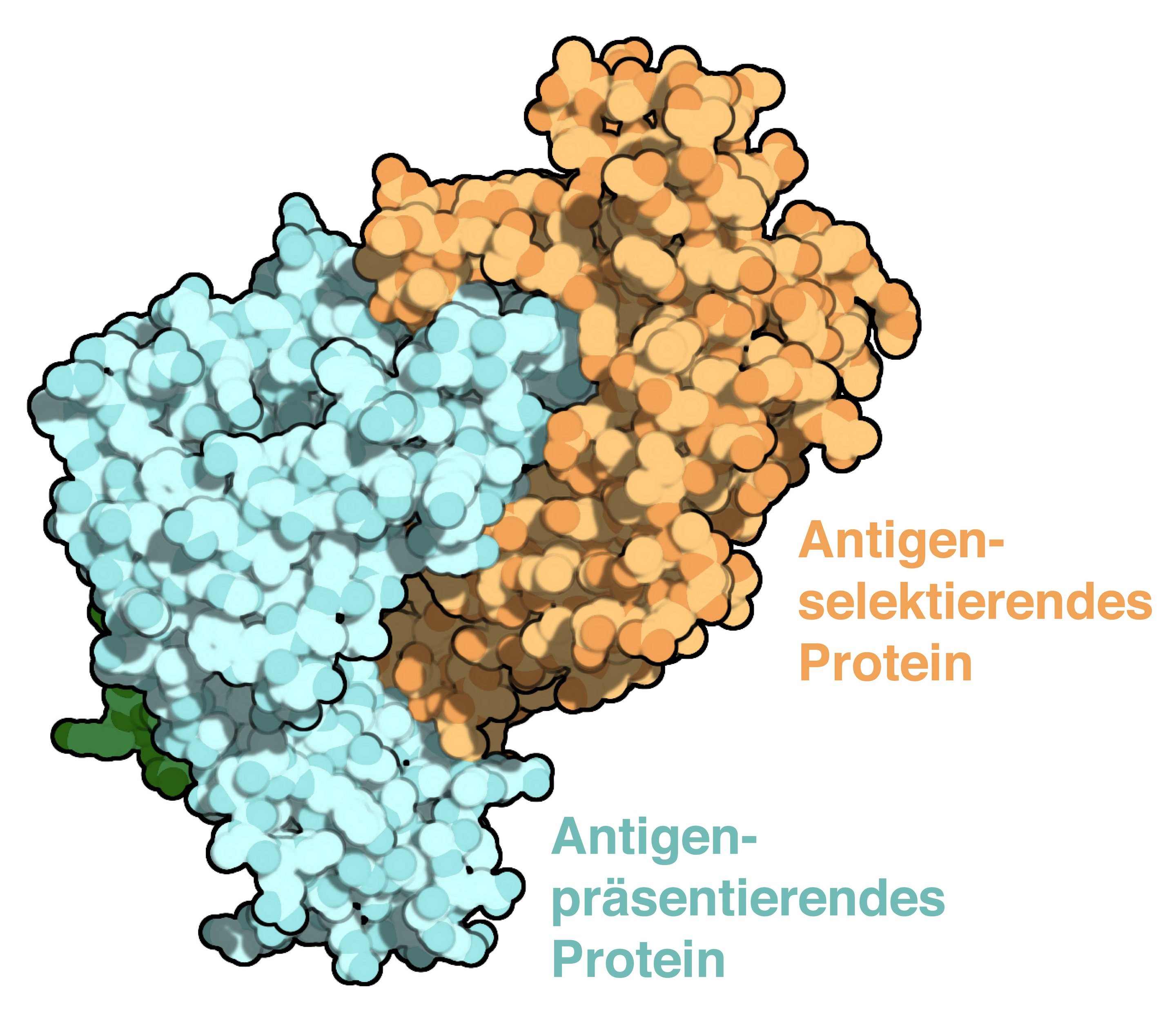
“L’immunità adattiva è formata da una selezione di peptidi presentati sulle principali molecole di classe I (MHC I) di istocompatibilità. I chaperoni Tapasin (Tsn) e TAP-binding legati alla proteina (TAPBPR) facilitano il carico del peptide MHC I e la selezione di epitopi ad alta affinità. Nonostante il ruolo fondamentale di Tsn e TAPBPR nel controllare la risposta immunitaria gerarchica, il loro meccanismo catalitico rimane sconosciuto. Nello studio i ricercatori presentano la struttura a raggi X del complesso TAPBPR-MHC I, che delinea la fase centrale della catalisi. TAPBPR funge da selettore peptidico rimodellando la regione MHC I α2-1-elica, stabilizzando la scanalatura di rilegatura vuota e inserendo un ciclo nella scanalatura che interferisce con il legame peptidico”.
Fonte: Science