Immagine: i livelli dei recettori IFNAR1 per l’interferone sono ridotti in profondità all’interno dei tumori solidi, aiutandoli a eludere un attacco del sistema immunitario.
Le immunoterapie hanno rivoluzionato il trattamento del cancro, eppure i tumori solidi sono spesso resistenti a questi approcci.
Nuove scoperte da un team dell’Università della Pennsylvania hanno rivelato come i tumori solidi evadono il rilevamento immunitario e mostrano come le immunoterapie possono essere modificate per affrontare anche questo tipo di tumori.
L’obiettivo dello studio è il recettore IFNAR1, che viene attivato dall’ interferone, una molecola che è nota per la lotta contro i tumori ed è essa stessa un trattamento per il cancro, le infezioni e altre condizioni. Quando si forma un tumore, l’ambiente ipossico della sua massa in rapida crescita porta ad una riduzione dei livelli di recettori dell”interferone sulle cellule T. Questa riduzionecausa la morte delle cellule T creando così un ambiente in cui le cellule tumorali possono sopravvivere e riprodursi in modo incontrollato.
“Abbiamo scoperto che è richiesta questa sottoregolazione del recettore per la generazione di nicchie immuno-privilegiate nel microambiente tumorale”, ha dichiarato Serge Y. Fuchs, Professore di biologia cellulare alla Facoltà di Medicina Veterinaria, Direttore del Mari Lowe Center for Comparative Oncology e autore senior dello studio. “Di conseguenza, questo riduce l’efficacia delle terapie immunitarie. Quindi, se siamo in grado di invertire questo processo, allora probabilmente possiamo migliorare l’esito del trattamento”.
( Vedi anche:Immunoterapia: ingegnerizzazione del sistema immunitario per uccidere le cellule tumorali).
Il lavoro è stato pubblicato dalla rivista Cancer Cell .
Il laboratorio Fuchs è stato a lungo incuriosito da IFNAR1, un recettore che svolge un ruolo importante nel cancro, infiammazione, malattie autoimmuni e infezioni virali. La maggior parte dei recettori cellulari sono soggetti ad un anello di retroazione negativa: quando la loro corrispondente molecola extracellulare attiva il recettore, si innesca un percorso che porta poi alla riduzione dell’attività dei recettori, presumibilmente per evitare alla cellula il sovraccarico di segnalazione attraverso quel percorso.
Eppure, circa un decennio fa, Fuchs e colleghi hanno scoperto che IFNAR1 è sotto regolato non solo al momento dell’attivazione dell’interferone, ma anche attraverso un altro percorso che priva le cellule della loro capacità di riconoscere l’interferone.
“E quando abbiamo scoperto che alcuni degli stimoli che possono rimuovere IFNAR1 dalla superficie cellulare sono simili a quelli che si verificano nel microambiente tumorale”, ha detto Fuchs, ” siamo diventati curiosi di sapere se la perdita del recettore avviene anche nei tumori”.
I tumori solidi presentano un ambiente stressante. Crescono così rapidamente che la crescita dei vasi sanguigni non può tenere il loro passo, così le cellule più profonde all’interno dei tumori sono spesso lasciate prive di ossigeno o di sostanze nutritive come glucosio e amminoacidi.
Allo stesso tempo, i ricercatori, tra cui l’autore dello studio Koumenis, avevano scoperto che i geni immuno-correlati hanno ridotta espressione nel microambiente tumorale in profondità, creando quella che viene definita come una nicchia immuno-privilegiata.
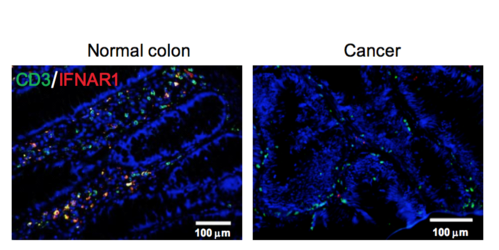
Nel lavoro attuale, il team di ricerca ha esaminato se IFNAR1 è coinvolto in questo processo, osservando in particolare il tumore del colon retto, una malattia che non risponde bene alle immunoterapie. Esaminando i campioni di tessuto da persone con cancro del colon-retto, i ricercatori hanno trovato differenze impressionanti nei livelli di proteina IFNAR1 tra tessuto normale e tumorale; le cellule tumorali hanno mostrato perdita completa o quasi completa della proteina. Questa perdita è stata anche associata ad esiti più poveri nei pazienti.
I ricercatori hanno poi utilizzato i topi per determinare esattamente come la perdita di IFNAR1 è collegata alla crescita del tumore. I topi con una forma di cancro del colon-retto hanno mostrato un corrispondente calo delle proteine IFNAR1, ma quelli allevati per avere una forma di IFNAR1 resistente alla degradazione hanno sviluppato meno tumori.
In seguito i ricercatori hanno utilizzato modelli di topi che avevano ricevuto un trapianto di cellule tumorali. Mentre i tumori sono cresciuti nei topi geneticamente normali, i topi con IFNAR1 resistente al degrado hanno sia respinto le cellule tumorali che sviluppato in ritardo la crescita tumorale.
Poiché le cellule T sono note per essere in grado di combattere i tumori, i ricercatori hanno esaminato i livelli di cellule T nei topi con IFNAR1 resistente al degrado rispetto ai topi normali e hanno scoperto che il secondo gruppo aveva un numero significativamente ridotto di cellule immunitarie, compresi i cosiddetti linfociti T “killer”, all’interno dei tumori. Ulteriori esperimenti hanno confermato che la sottoregolazione di IFNAR1 ha notevolmente diminuito la capacità delle cellule T di sopravvivere nel microambiente tumorale.
Questa scoperta contribuisce a spiegare perché le immunoterapie basate sulle cellule T geneticamente ingegnerizzate hanno una bassa efficacia nei tumori solidi: semplicemente non possono sopravvivere abbastanza a lungo per avere un effetto contro le cellule tumorali.
Per mettere i loro risultati in azione, i ricercatori hanno ottimizzato l’approccio immunoterapico delle cellule T tipico, stabilizzando IFNAR1 nelle cellule T trasferite, inattivando o inibendo gli enzimi normalmente coinvolti nella degradazione del recettore. Questo processo è stato in grado di ripristinare i livelli dei recettori nei linfociti T citotossici, aumentando il loro numero all’interno dei tumori solidi, dove avevano un forte effetto anti-oncogeno.
“Sulla base di questi risultati siamo stati in grado di creare una immunoterapia migliore”, ha detto Fuchs che insieme ai suoi colleghi sta lavorando per sviluppare un modello in cui potrebbero usare un farmaco per stabilizzare i recettori e sta anche indagando su un modo per mettere un recettore stabilizzato in una terapia cellulare CAR-T.
“Tecnicamente non è molto semplice, ma dovrebbe essere fattibile”, ha detto Fuchs. “E questo sarebbe molto, molto importante per il trattamento dei tumori solidi”, ha concluso il ricercatore.
Fonte: Penn News