Gli scienziati della Rice University hanno scoperto nuovi dettagli su come una sequenza nucleotidica ripetuta nel gene che codifica per una proteina mutante può innescare malattie neurologiche come, ad esempio, la malattia di Huntington.
I ricercatori del Researchers at Rice’s Center for Theoretical Biological Physics hanno utilizzato modelli informatici per analizzare le proteine sospettate di misfolding e le placche che si formano nel cervello dei pazienti affetti da malattie neurologiche. Le loro simulazioni hanno confermato i risultati sperimentali di altri laboratori che hanno dimostrato che la lunghezza delle ripetezioni delle sequenze di poliglutamine contenute nelle proteine è fondamentale per l’insorgenza delle malattie neurologiche.
Lo studio, condotto da Peter Wolynes del Rice’s Center for Theoretical Biological Physics, appare nel Journal of American Chemical Society .
La glutammina è l’aminoacido codificato dai tre trinucleotidi CAG. Le ripetizioni di glutammina, chiamate poliglutamine, sono normali nella proteina huntingtina, ma quando il DNA viene copiato in modo non corretto, la sequenza ripetuta di glutammina può diventare troppo lunga.
Il risultato può essere lo sviluppo di malattie neurologiche come la malattia di Huntington o l’atassia spinocerebellare.
Il numero di ripetizioni della glutammina può crescere in quanto le informazioni del codice genetico sono tramandate di generazione in generazione. Ciò significa che un genitore sano il cui gene huntingtina codifica proteine con 35 ripetizioni può generare un figlio con 36 ripetizioni. Una persona che ha questa ripetizione in più, ha più probabilità di sviluppare la malattia di Huntington.
https://www.youtube.com/watch?time_continue=2&v=9kk8rSiH3p8
Una simulazione mostra 20-ripetizioni di poliglutamine che si aggregano. Le proteine a bassa ripetizione richiedono almeno quattro o più ripetizioni in prossimità del nucleo attorno al quale possono formare aggregati. Credit: Wolynes Research Lab / Rice University
L’aggregazione nella malattia di Huntington inizia in genere solo quando le catene di poliglutamine raggiungono una lunghezza critica di 36 ripetizioni. Gli studi hanno dimostrato che le catene più lunghe possono rendere la malattia più grave e la sua insorgenza precoce.
La sperimentazione si basa su tecniche utilizzate in un precedente studio sulle proteine beta amiloidi. Questo studio è stato il primo tentativo del laboratorio di modellare il paesaggio di energia nell’aggregazione delle beta amiloidi implicate nella malattia di Alzheimer.
Questa volta, Wolynes ed il suo team erano interessati a capire come la lunghezza variabile di ripetizioni-da un minimo di 20 e fino a 50-può influenzare il modulo di aggregati.
“La forma finale della proteina, rilevata nelle persone che hanno la malattia di Huntington, è un aggregato macroscopico fatto di molte molecole, molto simile a un cristallo di ghiaccio”, ha detto Wolynes. ” Poichè questo processo deve cominciare da qualche parte, ci siamo chiesti se il nucleo, il cluster di dimensione più piccola, è in grado di completare il processo e raggiungere dimensioni macroscopiche”.
“Sapevamo che la lunghezza delle ripetizioni è correlata alla gravità di una malattia, ma abbiamo voluto scoprire che cosa porta alla dimensione critica”, ha detto il ricercatore.
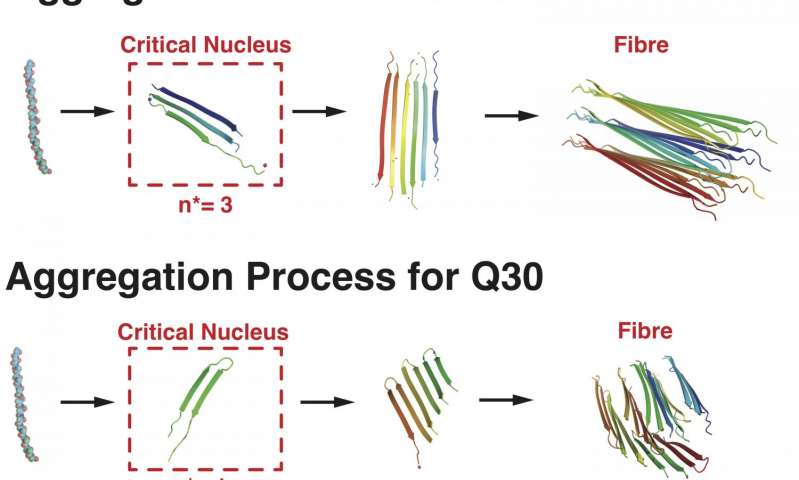
Gli esperimenti hanno dimostrato che le sequenze di 20 ripetizioni erano in grado di aggregarsi in un nucleo solo quando quattro o più ripetizioni si erano riunite in prossimità del nucleo stesso.
Le simulazioni dei ricercatori hanno dimostrato come sequenze di proteine con 30 ripetizioni o più, sono in grado di ripiegarsi in forme tornanti, che sono i mattoni dei più pericolosi aggregati. Così, nelle sequenze più lunghe, anche una singola proteina può iniziare il processo di aggregazione, soprattutto nelle alte concentrazioni.
Il team ha scoperto che nelle lunghezze intermedie, tra 20 e 30 ripetizioni, le sequenze di poliglutamine possono scegliere tra configurazioni diritte o a tornante. Mentre sequenze più lunghe e le forma più brevi sono allineate in fasci di fibre, le simulazioni hanno mostrato che le sequenze intermedie sono più propense a formare disordinate strutture ramificate.
https://www.youtube.com/watch?time_continue=2&v=YlV3dCFIpZg
Una simulazione mostra 30-ripetizioni di polglutamine aggreganti a rallentatore. Credit: Wolynes Research Lab / Rice UniversityUna
“Non sappiamo se la ramificazione è innocua o pericolosa”, ha detto Wolynes. “Ma spiega le forme strane che abbiamo ottenuto nelle sperimentazioni in provetta”.
Le mutazioni che potrebbero incoraggiare le sequenze di poliglutamine, portano a proteine non ripiegate per alzare la barriera energetica di aggregazione. “La cosa ironica è che, mentre la malattia di Huntington è stata classificata come una malattia da misfolding, accade che la proteina, nel brutto caso di ripetizioni più lunghe, svolge un processo di ripiegatura in più che non avrebbe dovuto compiere”, ha spiegato Wolynes .
Fonte: News Rice