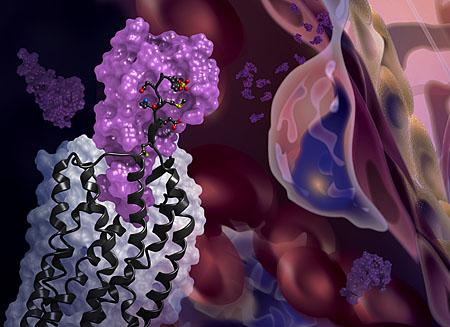
I ricercatori della University of California, San Diego Skaggs School of Farmacy e del Bridge Institute presso la University of Southern California, hanno, per la prima volta, fotografato la struttura cristallina del recettore cellulare CXCR4 legato ad una proteina immunitaria di segnalazione, chiamata chemochina.
La struttura, riportata il 22 gennaio sulla rivista Science, risponde alle domande di lunga data circa un’interazione molecolare che svolge un ruolo importante nello sviluppo umano, le risposte immunitarie, le metastasi del cancro e l’ infezioni HIV.
” Questa nuova informazione potrebbe favorire lo sviluppo di inibitori molecolari di CXVR4/chemochina, inibitori che hanno il potenziale di bloccare le metastasi del cancro o le infezioni virali”, ha spiegato Tracy M. Handel, professore di farmacologia presso la UC di San Diego e autore senior dello studio.
CXCR4 è un recettore che si trova sulla superficie esterna delle cellule, dove sporge come un’antenna. Quando riceve un messaggio dalle molecole di segnalazione chiamate chemochine, il recettore si lega alle chemochine e trasmette il messaggio all’interno delle cellule. La ricezione del messaggio aiuta la cellula a migrare normalmente durante lo sviluppo e l’infiammazione. Ma la segnalazione CXCR4 può anche svolgere un ruolo nella migrazione delle cellule anormali, come nel caso di cellule tumorali che migrano per metastatizzare. CXCR4 è tristemente noto anche per un altro motivo: l’HIV usa il recettore CXCR4 per legare ed infettare le cellule immunitarie umane. Nonostante le sue gravi conseguenze, i ricercatori avevano a lungo cercato di vedere come avviene esattamente l’interazione tra CVCR4 e le chemochine o su quanti recettori CXCR4, una chemochina poteva simultaneamente legarsi.
Come recettori, CXCR4 sono obiettivi strutturali particolarmente impegnativi e la difficoltà aumenta notevolmente, quando si studiano recettori complessi che si legano alle proteine.
Per superare queste sfide sperimentali, la squadra di Handel ha utilizzato un nuovo aproccio. I ricercatori hanno combinato una modellazione computazionale ed una tecnica nota come disolfuro trapping, per stabilizzare il complesso. Una volta stabilizzato, i ricercatori sono stati in grado di utilizzare la cristallografia a raggi X per determinare la struttura atomica 3D del complesso CXCR4-chemochine.
Questa è la prima volta che il recettore CXCR4 viene fotografato con una proteina partner legante ed i risultati hanno rivelato diverse nuove intuizioni. Innanzitutto, la nuova struttura cristallina mostra che una chemochina si lega ad un solo recettore ed il suo partner di legame è più esteso del previsto: è una superficie molto grande di interazione contigua piuttosto che due siti distinti di legame.
” La plasticità del recettore CXCR4, la sua capacità di legare molte piccole molecole indipendenti, sono notevoli”, ha spiegato Irina Kufareva, uno scienziato computazionale della UC di San Diego e co- autore dello studio. ” La nostra comprensione di questa plasticità potrebbe influire sulla progettazione di terapie con migliori profili di inibizione e sicurezza”.
Fonte http://www.eurekalert.org/pub_releases/2015-01/uoc–ptf012215.php