In qualsiasi manuale di biologia introduttiva, una delle prime cose che si impara è che il nostro DNA contiene le istruzioni per assemblare le proteine, piccole macchine che svolgono gran parte del lavoro nelle cellule del nostro corpo.
Tuttavia, i risultati di uno studio pubblicato il 2 gennaio dalla rivista Science, sfidano i libro di testo mostrando per la prima volta che gli elementi costitutivi di una proteina, gli amminoacidi, possono essere aggregati senza i modelli di DNA e RNA messaggero che fungono da stampo.
“Questa scoperta sorprendente riflette quanto è incompleta la nostra comprensione della biologia”, dice il primo autore Peter Shen, Ph.D., un borsista post-dottorato in biochimica, all’Università di Utah. “La natura è capace di più di quanto pensiamo”.
Per comprendere la nuova scoperta, potrebbe essere utile pensare al sistema cellulare come una fabbrica ben gestita. I ribosomi sono macchine su una linea di assemblaggio di proteine, che collegano tra lorogli amminoacidi in un ordine specificato dal codice genetico. Quando qualcosa va storto, il ribosoma va in stallo e degli elementi di controllo di qualità si attivano nel sito. Per far ripartire la macchina dei ribosomi, occorre ripulire il sito dal guasto. Il ribosoma viene smontato, il progetto viene scartato e la proteina prodotta, in parte viene riciclata.
Ma questo studio rivela un ruolo sorprendente di un membro del team di controllo di qualità, una proteina chiamata Rqc2. Prima che la proteina incompleta venga riciclata, Rqc2 richiede ribosomi per aggiungere solo due aminoacidi (su un totale di 20) – treonina e alanina – in qualsiasi ordine. Pensate a una catena di montaggio di auto che continua ad andare avanti pur avendo perso le istruzioni.
“In questo caso, abbiamo una proteina che gioca un ruolo normalmente svolto da mRNA”, dice Adam gelo, MD, Ph.D., professore assistente presso l’Università della California, San Francisco (UCSF) e professore aggiunto di biochimica all’Università di Utah. Egli condivide la ricerca con l’autore senior Jonathan Weissman, Ph.D., un Howard Hughes Medical Institute presso UCSF e Onn Brandman, Ph.D., presso la Stanford University. “Amo questa storia perché confonde le linee di quello che pensavamo sui compiti delle proteine”.
Come una macchina assemblata a metà e con le ruote applicate solo ad una estremità, una proteina tronca, con una sequenza apparentemente casuale di alanina e treonina, sembra strana e probabilmente non funziona normalmente. Ma la sequenza assurda è probabile che abbia obiettivi specifici. Il codice può segnalare che la proteina parziale deve essere distrutta o potrebbe essere parte di un test per verificare se il ribosoma funziona corretamente. L’evidenza suggerisce che uno o entrambi questi processi potrebbero essere difettosi nelle malattie neurodegenerative come la sclerosi laterale amiotrofica, la malattia di Alzheimer o la malattia di Huntington.
“Ci sono molte implicazioni interessanti di questo lavoro e nessuna sarebbe stata possibile se non avessimo seguito la nostra curiosità”, dice Brandman. “Il driver principale della scoperta sta nell’ esplorazione di ciò che si vede e questo è quello che abbiamo fatto. Non ci sarà mai un sostituto di questo”.
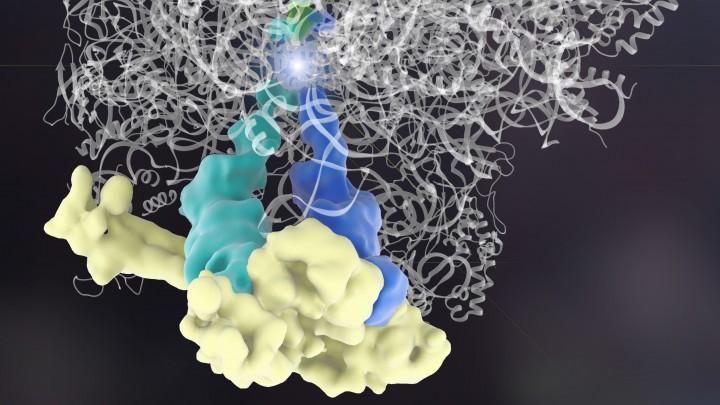
Gli scienziati, quando hanno osservato lo strano e insolito fenomeno, hanno affinato una tecnica chiamata microscopia a crio-elettroni per congelare e poi visualizzare il meccanismo di controllo di qualità in azione. ” Abbiamo catturato Rqc2 in atto”, dice Frost. “Ma l’idea era così inverosimile. Spettava a noi dimostrarla!”.
E’ stata necessaria un’ampia analisi biochimica per convalidare l’ipotesi dei ricercatori. Le nuove tecniche di sequenziamento RNA hanno mostrato che il complesso ribosoma – Rqc2 ha il potenziale di aggiungere amminoacidi alle proteine in stallo perché vincola tRNA, strutture che aggiungono amminoacidi alla catena di montaggio delle proteine. I tRNA specifici che sono stati osservati, trasportano solo il alanina e treonina. Il risultato è giunto quando i ricercatori hanno osservato che le proteine in stallo avevano vaste catene di alanine e treonina, aggiunte ad esse.
“Il nostro compito ora è quello di determinare quando e dove questo processo avviene e cosa succede quando fallisce”, spiega Frost.
Fonte http://www.eurekalert.org/pub_releases/2015-01/uouh-dts122914.php