Rob Meijers, del Laboratorio europeo di biologia molecolare (EMBL), ha guidato la ricerca e ritiene che essa potrebbe avere implicazioni di vasta portata:
“I nostri risultati ci aiuteranno a progettare efficaci batteriofagi specifici, non solo per le infezioni da clostridium difficile, ma per una vasta gamma di batteri legati alla salute umana, l’agricoltura e l’industria alimentare”.
Ogni anno, oltre mezzo milione di persone si ammalano a causa del Clostrridium difficile, avvertendo i sintomi come diarrea, crampi addominali, febbre,disidratazione e insufficienza renale. Una volta stabilitosi nell’ospite, il C. diff attacca il rivestimento dell’intestino con le sue tossine.
Uno degli aspetti più problematici di questo batterio è che gli antibiotici possono favorire il suo insediamento nell’intestino.
Se un antibiotico viene assunto per trattare un tipo di infezione, può distruggere alcuni dei batteri buoni che vivono nell’intestino e sono necessari per difenderci dal C. diff .
Il Clostridium difficile è comunemente trattato con altri antibiotici, ma è particolarmente insensibile a un gran numero di essi. Le recidive di infezioni da C. diff, riducono l’efficacia della terapia antibiotica e il rischio di recidiva aumenta se una persona assume altri antibiotici per un’altra condizione.
L’uso di batteriofagi potrebbe evitare questi problemi. Per utilizzarli, gli scienziati hanno bisogno di capire come essi distruggono le proprie pareti cellulari per attaccare il clostridium difficile.
Il co-autore dello studio, Matteo Dunne, spiega :
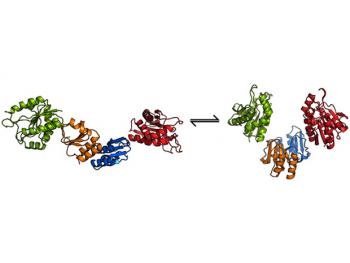
“Questi enzimi sembrano passare da una forma tesa, allungata, in cui una coppia di endolysins sono uniti tra loro, ad uno stato rilassato in cui i due endolysins si trovano fianco a fianco. Il passaggio da una conformazione all’ altra, rilascia l’enzima attivo, che poi inizia a degradare la parete cellulare”.
Passare da ‘standby’ alla modalità di ‘attacco’ del clostridium difficile da parte dei batteriofagi
Gli autori dello studio, pubblicato su PLoS Pathogens , sono stati in grado di scoprire il passaggio da una conformazione all’altra, lavorando sulla struttura 3D delle endolysins.
Gli scienziati hanno confrontato le strutture endolysin di due batteriofagi che colpiscono diverse specie di Clostridium batteri; uno che ha come obiettivo il Clostridium diffiile e uno che si rivolge a un ceppo di Clostridium che si trova nel formaggio in fermentazione.
Il meccanismo di attivazione è condiviso da entrambe le specie di Clostridiumbatteriofagi-targetinge e questo ha portato il team a concludere che si tratti di una caratteristica comune che potrebbe essere sfruttata per utilizzare altri virus per attaccare i batteri resistenti agli antibiotici.
Se la scoperta di questo interruttore strutturale consente agli scienziati di progettare virus come alternativa agli antibiotici, allora potrebbe significare la fine per le infezioni correlate all’assistenza ospedaliera, quali infezioni da C. diff , che rimane su livelli storicamente elevati ed è responsabile di 14.000 decessi legati alla diarrea, ogni anno.
Fonte:
‘The CD27L and CTP1L endolysins targeting Clostridia contain a built-in trigger and release factor,’ Meijers et al., PLOS Pathogens, http://dx.plos.org/10.1371/journal.ppat.1004228, published 24 July 2014, abstract.
EMBL news release, accessed 24 July 2014 via Alpha Galileo.