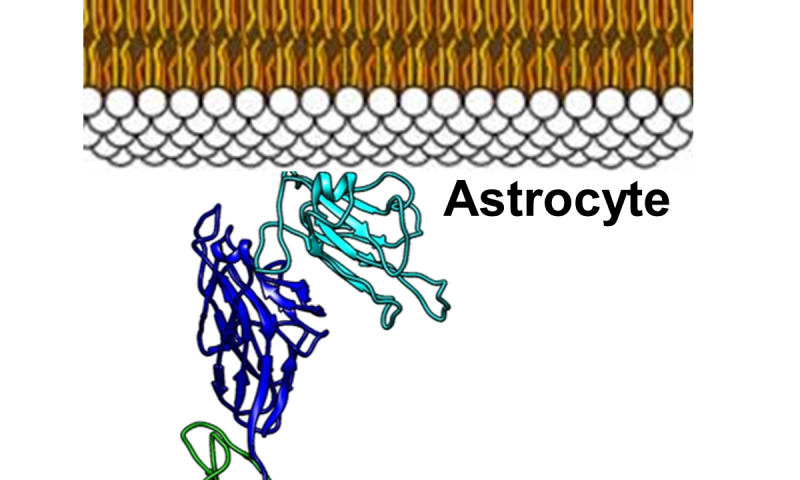
Immagine: Pellecchia e colleghi ipotizzano che le interazioni tra i motoneuroni e astrociti sono responsabili, almeno in parte, della progressione della morte dei motoneuroni nei pazienti con SLA. Queste interazioni sono mediare dal recettore EphA4 sui motoneuroni e dalla proteina ephrin-B2 (azzurro) che si trova sulla superficie degli astrociti – cellule gliali a forma di stella nel cervello e midollo spinale. I ricercatori hanno sviluppato una molecola che è in grado di rompere le interazioni tra EphA4 e efrina-B2. Credit: Laboratorio Pellecchia, UC Riverside.
Un team di scienziati biomedici ha identificato una molecola che ha come bersaglio un gene noto a svolgere un ruolo fondamentale nella rapida progressione della sclerosi laterale amiotrofica (SLA), una malattia neurodegenerativa che colpisce i neuroni motori, le cellule nervose nel cervello e midollo spinale che collegano il sistema nervoso ai muscoli volontari del corpo.
La ricerca, svolta su un modello murino di SLA, mira a bloccare il gene fornendo così un importante punto di partenza per lo sviluppo di nuovi trattamenti per ritardare la progressione della SLA e potenzialmente, di altre malattie umane.
( Vedi anche:Il riequilibrio del microbioma intestinale allunga la sopravvivenza in modello murino di SLA).
In particolare, il team, guidato da Maurizio Pellecchia, Prof. di Scienze biomediche presso la Facoltà di Medicina della University of California, Riverside, riporta nella rivista Cell Chemical Biology come la molecola progettata in laboratorio, chiamata 123C4, che ha come obiettivo il recettore del gene EphA4, (questo gene appartiene alla sottofamiglia dei recettori efrina della famiglia protein-tirosin chinasi. EPH e recettori EPH connessi sono stati implicati nella mediazione di eventi di sviluppo, specialmente nel sistema nervoso), è efficace nel ritardare la progressione della SLA.
È importante sottolineare che l’espressione di EphA4 è associata non solo alla progressione della malattia dei motoneuroni, ma anche ad altre condizioni compresa l’anormale coagulazione del sangue, lesioni cerebrali e del midollo spinale, morbo di Alzheimer, così come tumori gastrici e pancreatici.
“La ricerca, nel valutare il valore terapeutico di EphA4 in queste malattie, è stata ostacolata, però, dalla mancanza di adeguati inibitori farmacologici di EphA4″, ha spiegato il Prof. Pellecchia, che detiene la cattedra al Daniel Hays Endowed Chair in Cancer Research ed è il Direttore del Center for Molecular and Translational Medicine. ” Anche se l’esatto meccanismo responsabile dell’ efficacia terapeutica del nostro agente 123C4 deve essere ancora pienamente compreso, siamo fiduciosi che 123C4 – o suoi derivati – troveranno ampia applicazione negli studi preclinici e sperimentazioni cliniche umane per il trattamento della SLA e potenzialmente altri disturbi umani “.
Pellecchia ha sottolineato che studi genetici recenti sulle persone colpite dalla malattia, così come su modelli animali di SLA, indicano chiaramente che il recettore EphA4 potrebbe essere un bersaglio farmacologico atto a ritardare la progressione della morte del motoneurone.
“E’ stato un viaggio lungo e difficile progettare 123C4 in laboratorio”, ha aggiunto il ricercatore.
Per ricavare la molecola, il laboratorio di Pellecchia ha utilizzato un approccio che è stato sviluppato di recente e che fonde la chimica combinatoria e metodi biofisici basati sulla spettroscopia di risonanza magnetica nucleare ((NMR) (la Spettroscopia di Risonanza Magnetica Nucleare (NMR) è una tecnica analitica molto potente che permette di ottenere dettagliate informazioni sulla struttura molecolare dei composti in esame. Laspettroscopia NMR misura l’assorbimento diradiazione elettromagnetica in molecole immerse in un forte campo magnetico), e testato più di 100.000 possibili candidati. La ricerca ha comportato anche una combinazione di una vasta gamma di altre tecniche sofisticate e approcci, che vanno dalla chimica farmaceutica, biologia cellulare e di imaging, alla farmacologia in vivo e studi di efficacia che hanno utilizzato modelli di topi transgenici di SLA.
Ha detto Pellecchia: “Targeting EphA4 è stato particolarmente impegnativo, ma la sua associazione con la progressione della SLA ci ha ispirato ad aumentare i nostri sforzi in questo campo, negli ultimi anni”.
Egli ha osservato che la maggior parte degli studi suggeriscono che ridurre geneticamente i livelli decrescenti di EphA4 in modelli animali transgenici di SLA ha prolungato la sopravvivenza degli animali e intuitivamente, si può immaginare che il blocco di EphA4 con la molecola progettata potrebbe avrebbe lo stesso effetto.
“Infatti 123C4 aumenta la sopravvivenza in modelli murini di SLA, ma agisce come un agonista EphA4 e non un antagonista”, ha detto Pellecchia, che ha spiegato che un agonista è una sostanza che stimola l’azione chimica, mentre un antagonista blocca tale azione. “Abbiamo dimostrato che l’interazione 123C4 /EphA4 fa sì che il recettore fosse interiorizzato da un processo noto come endocitosi , un processo iniziato solo da un agonista. Noi ipotizziamo che inducendo la internalizzazione recettoriale, 123C4 rimuove efficacemente EphA4 dalla superficie dei neuroni motori”.
Il modello di topo transgenico che Pellecchia ed i suoi colleghi hanno utilizzato per lo studio è stato ampiamente adottato come standard per selezionare candidati farmaci come potenziali terapie SLA. Ma diverse sfide attendono i ricercatori prima di portare 123C4 alla sperimentazione clinica per confermare che gli studi di laboratorio si possono tradurre in modo efficace nei pazienti affetti da SLA.
Hanno collaborato allo studio Surya K. De, Anna Kulinich, Ahmed Salem F., Giordano Joeppen, Elisa Barile e Iryna Ethell, un Prof. di scienze biomediche alla UC Riverside e Bainan Wu (il primo autore dell’articolo), Rengang Wang, Si Wang e Zhang Dongxiang del Sanford-Burnham-Prebys Medical Discovery Institute e La Jolla, in California.
I ricercatori hanno in programma di sviluppare agenti aggiuntivi basati su 123C4 sia con attività antagonista che con attività agonista migliorata e testare questi agenti in modelli animali di SLA.
“In collaborazione con l’Iron Horse Therapeutic, speriamo che questi studi supplementari possano ulteriormente facilitare la traduzione di questi agenti in nuovi trattamenti per la SLA”, ha concluso Pellecchia.
Fonte: Cell Chemical Biology